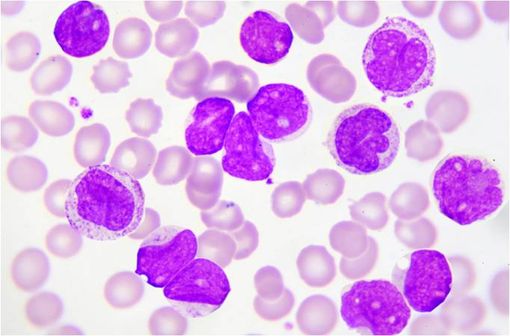
La leucémie aiguë lymphoblastique est provoquée par la multiplication de lymphocytes défaillants dans la moelle osseuse appelés blastes (illustration).
EDIT du 27 septembre 2018 : nouvelle rupture de stock - recours à des unités d'ERWINASE britanniques pour renforcer le marché français (lot 189G118, péremption 28 février 2021), distribuées auprès des PUI à compter du 26 septembre 2018. /FIN EDIT
Reprise de la distribution de manière contingentée
La distribution de l'antinéoplasique hospitalier ERWINASE 10 000 UI U/flacon poudre pour solution pour injection (Cf. Encadré 1) a repris de manière contingentée auprès des pharmacies hospitalière depuis le 9 août 2018.
Encadré 1 - Indications thérapeutiques d'ERWINASE
| ERWINASE est un antinéoplasique à base de crisantaspase (asparaginase d'Erwinia chrysanthemi : L-asparaginase d'Erwinia) utilisé, en association à d'autres agents chimiothérapeutiques, pour le traitement des patients, principalement pédiatriques, atteints de leucémie aiguë lymphoblastique chez qui une hypersensibilité (allergie clinique ou inactivation silencieuse) à l'asparaginase native ou pégylée dérivée d'E. coli est apparue. |
Ce lot, comme les suivants, ne nécessite donc pas de filtration additionnelle, contrairement aux lots importés et mis sur le marché durant la rupture de stock d'ERWINASE en France (notre article du 15 mai 2018).
Dans une lettre d'information en date du 7 août 2018, le laboratoire Jazz Pharmaceutical rappelle toutefois aux pharmaciens hospitaliers "que dans l'éventualité où des particules seraient identifiées après reconstitution de la solution d'ERWINASE, la solution reconstituée ne doit pas être administrée".
Pour aller plus loin
ERWINASE 10 000 UI/flacon, poudre pour solution pour injection - Remise à disposition (9 août 2018)
Lettre d'information du laboratoire JAZZ PHARMACEUTICALS France SAS à l'attention des Pharmaciens hospitaliers en date du 07 août 2018 (sur le site de l'ANSM, 9 août 2018)
EDIT du 27 septembre 2018 :
ERWINASE 10 000 unité/flacon poudre pour solution pour injection - Rupture de stock (ANSM, 26 septembre 2018)
Lettre de Jazz Pharmaceuticals aux professionnels de santé (sur le site de l'ANSM, 25 septembre 2018)
/FIN EDIT
Sur VIDAL.fr
ERWINASE (crisantaspase) : rupture de stock jusqu'au 8 août 2018 (30 juillet 2018)
Rupture de stock d'ERWINASE (crisantaspase) : des unités britanniques à nouveau mises à disposition (15 mai 2018, edit 13 juin 2018)
ERWINASE : rupture de stock jusqu'au 19 mai et mobilisation des stocks hospitaliers pour les besoins urgents (2 mai 2018)
Rupture de stock d'ERWINASE (crisantaspase) : nouvelle mise à disposition d'unités britanniques (28 mars 2018)
ERWINASE (crisantaspase) : brève rupture de stock et mobilisation des stocks détenus dans les PUI (14 mars 2018)
ERWINASE (crisantaspase) : rupture de stock et mise à disposition d'unités britaniques (16 novembre 2016)
Rupture de stock d'ERWINASE (crisantaspase) : importation d'unités destinées au marché britannique (1er juin 2016)
ERWINASE (crisantaspase) : rupture de stock et mise à disposition d'unités initialement destinées au Canada (18 mai 2016)
Pour aller plus loin
Consultez les monographies VIDAL
Pour recevoir gratuitement toute l’actualité par mail Je m'abonne !

 3 minutes
3 minutes Ajouter un commentaire
Ajouter un commentaire.jpg)





Commentaires
Cliquez ici pour revenir à l'accueil.