
La narcolepsie de type I est caractérisée par une somnolence diurne excessive associée à des accès irrépressibles de sommeil qui apparaissent généralement à l’adolescence.
Alors qu'elle ne s'appliquait qu'à l'adulte, la prise en charge (agrément aux collectivités, rétrocession) de XYREM 500 mg/mL solution buvable (oxybate de sodium) dans le traitement de la narcolepsie avec cataplexie est désormais étendue à la population pédiatrique, chez l'adolescent et l'enfant à partir de 7 ans pharmacorésistants.
Cette prise en charge est conditionnée au respect des règles de prescription en vigueur (médicament stupéfiant, prescription restreinte). Elle est subordonnée à la décision d'instauration du traitement, prise après proposition documentée issue d'une réunion de concertation thérapeutique avec un centre de référence et de compétences dans la prise en charge de la narcolepsie.
La prise en charge dans cette indication est subordonnée à la décision d'instauration du traitement, prise après proposition documentée, issue d'une réunion de concertation thérapeutique avec un centre de référence et de compétences dans la prise en charge de la narcolepsie.
Encadré 1 - Indication thérapeutique de XYREM (AMM, 20 décembre 2021)
| Traitement de la narcolepsie chez les patients adultes, les adolescents et les enfants à partir de 7 ans présentant une cataplexie (cf. VIDAL Reco "Narcolepsie et hypersomnie idiopathique"). |
Cette prise en charge est par ailleurs conditionnée au respect des règles de prescription en vigueur (cf. Encadré 2).
Encadré 2 - Règles de prescription applicables à XYREM
|
SMR important et ASMR IV, uniquement en cas de pharmacorésistance
XYREM a obtenu cette indication dans le traitement de la narcolepsie pédiatrique en novembre 2020.
Les données cliniques en faveur de l'utilisation de XYREM chez l'enfant
La décision d'accorder cette extension d'indication repose principalement sur les résultats de l'étude de supériorité de phase II/III 13-005 (1) de retrait de traitement, multicentrique, randomisée, en double aveugle, versus placebo, réalisée chez 106 enfants et adolescents de 7 à 17 ans atteints de narcolepsie avec cataplexie.
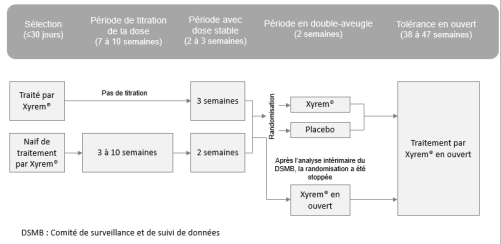
Selon les résultats de cette étude, la supériorité de l'oxybate de sodium par rapport au placebo a été démontrée sur la variation du nombre médian de crises de cataplexies hebdomadaires entre les deux dernières semaines de la période de stabilisation et les deux semaines de la période en double-aveugle, lors de :
- l'analyse intermédiaire (date d'analyse du 11 janvier 2016, 35 patients inclus) : différence de 0,0 crise versus 12,7 crises ; p = 0,0002, inférieur au seuil de significativité prédéfini de 0,005 ;
- l'analyse finale (date d'analyse du 10 février 2017, 63 patients inclus) : différence de 0,3 crise vs 12,7 crises ; p < 0,0001, inférieur au seuil de significativité prédéfini de 0,048.
L'avis de la CT en synthèse
Sur la base des données disponibles lors de son évaluation (avis du 21 juillet 2021), la Commission de la Transparence (CT) a attribué à XYREM :
- un service médical rendu (SMR) important dans le traitement de la narcolepsie avec cataplexie uniquement chez les adolescents et les enfants à partir de 7 ans pharmacorésistants (cf. Encadré 3). Cet SMR est jugé insuffisant chez les enfants non pharmacorésistants ;
- une amélioration du SMR mineure (ASMR IV).
La CT a pris en compte les résultats de l'étude 13-005 ainsi que de l'absence de données versus comparateur actif "dans un contexte où la moitié des patients (50 %) avaient reçu des traitements antérieurs par stimulants (principalement du méthylphénidate et du modafinil), puis de façon concomitante tout au long de l'étude".
La CT a par ailleurs noté le profil de tolérance de XYREM en pédiatrie, similaire à celui déjà connu chez l'adulte, marqué notamment par le risque de dépression respiratoire, d'état dépressif et de risque suicidaire, ainsi que les risques d'abus ou de mésusage.
Elle attire enfin l'attention sur les modalités d'administration du médicament en deux prises fractionnées (au coucher et 2,5 à 4 heures plus tard) qui peuvent induire des difficultés d'observance des patients.
Selon la CT, la population cible estimée en France s'élève à 324 patients.
Encadré 3. Prise en charge de la narcolepsie chez l'enfant et l'adolescent : recommandations (consensus français 2017)
| La prise en charge de la narcolepsie chez l'enfant et l'adolescent repose sur les mêmes traitements psychostimulants et anti-cataplectiques de première et de seconde intention que chez l'adulte. Les molécules suivantes sont ainsi citées en usage hors AMM chez l'enfant et l'adolescent :
|
XYREM en pédiatrie : consignes posologiques
Chez les adolescents et enfants à partir de 7 ans et avec un poids corporel minimum de 15 kg, XYREM est administré par voie orale 2 fois par nuit (cf. Tableau I).
Tableau I - Oxybate de sodium - Dose initiale et schéma de titration recommandés pour les patients pédiatriques
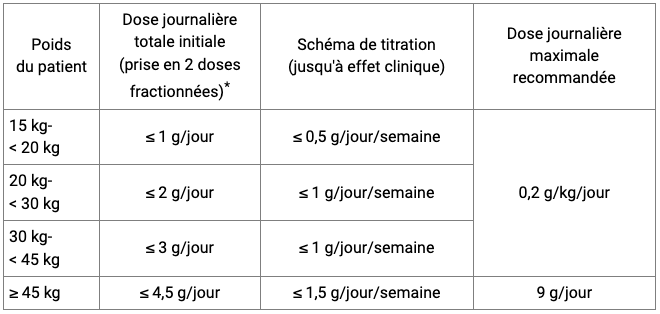
* Au coucher et 2,5 à 4 heures plus tard. Pour les enfants qui dorment plus de 8 heures par nuit, l'oxybate de sodium peut être administré après le coucher, tandis que l'enfant est au lit, en deux doses fractionnées égales à 2,5 à 4 heures d'intervalle.
Arrêté du 30 novembre 2021 modifiant la liste des spécialités pharmaceutiques agréées à l'usage des collectivités et divers services publics (Journal officiel du 10 décembre 2021 - texte 37)
Arrêté du 30 novembre 2021 relatif aux conditions de prise en charge de spécialités pharmaceutiques disposant d'une autorisation de mise sur le marché inscrites sur la liste visée à l'article L. 5126-6 du code de la santé publique (Journal officiel du 10 décembre 2021 - texte 38)
Avis de la Commission de la Transparence - XYREM, narcolepsie pédiatrique (HAS, 21 juillet 2021)
(1) Plazzi G, Ruoff C, Lecendreux et al. Treatment of paediatric narcolepsy with sodium oxybate: a double- blind, placebo-controlled, randomised-withdrawal multicentre study and open-label investigation. Lancet Child Adolesc Health. 2018 ; 2 : 483-94
EDIT du 22 décembre 2021 : Mesures additionnelles de réduction du risque validées par l'ANSM et diffusées par le(s) laboratoire(s) exploitant(s) le(s) médicament(s) [ANSM, 22 décembre 2021]/ Fin Edit

 5 minutes
5 minutes Ajouter un commentaire
Ajouter un commentaire





Commentaires
Cliquez ici pour revenir à l'accueil.