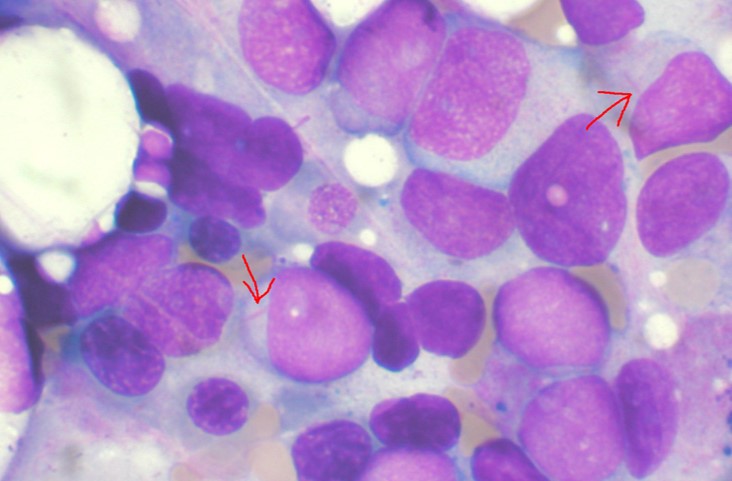
Leucémie aiguë myéloïde, les flèches indiquent les bâtonnets d'Auer, signes d'une atteinte myéloïde (illustration).
L'inhibiteur de tyrosine kinase RYDAPT 25 mg capsule molle est désormais disponible en pharmacie de ville, et bénéficie d'un remboursement à 100 % et d'un agrément aux collectivités.
Le principe actif de RYDAPT, la midostaurine, possède une activité inhibitrice sur un grand nombre de récepteurs tyrosine kinase et notamment les récepteurs c-KIT présents à la surface des mastocytes (cf. Encadré 1).
Encadré 1 - Mécanisme d'action de la midostaurine
| Selon les données in vitro disponibles, la midostaurine inhibe les récepteurs c-KIT porteurs de la mutation D816V, mutation retrouvée chez plus de 80% des patients atteints de mastocytose systémique, et dans une moindre mesure les récepteurs c-KIT non mutés. Ces récepteurs sont impliqués dans la régulation de la maturation, la prolifération et l'activation des mastocytes. La midostaurine interfère avec la signalisation anormale médiée par le récepteur c-KIT D816V et inhibe la prolifération, la survie et la libération d'histamine des mastocytes. |
RYDAPT est indiqué :
- dans le traitement des patients adultes présentant une leucémie aiguë myéloïde (LAM) nouvellement diagnostiquée avec mutation du gène FLT3,
- en association avec une chimiothérapie standard d'induction associant daunorubicine et cytarabine et une chimiothérapie de consolidation avec cytarabine à haute dose,
- suivie pour les patients en rémission complète, d'un traitement d'entretien par RYDAPT en monothérapie (cf. VIDAL Reco "Leucémies aiguës de l'adulte") ;
- dans le traitement des patients adultes présentant une mastocytose systémique agressive (MSA), une mastocytose systémique associée à une autre hémopathie maligne (MS-AHM), ou une leucémie à mastocytes (LM), en monothérapie.
RYDAPT fait l'objet d'une surveillance supplémentaire qui permettra l'identification rapide de nouvelles informations relatives à la sécurité. Les professionnels de santé déclarent tout effet indésirable suspecté.
SMR important dans le traitement de la LAM, faible dans le traitement des mastocytoses
RYDAPT a obtenu une autorisation de mise sur le marché (AMM) européenne en 2017, après une phase d'autorisation temporaire d'utilisation (ATU) nominative (2016), puis de cohorte (2017).
Depuis 2018, RYDAPT était distribué uniquement à l'hôpital, et bénéficiait d'une prise en charge en relais d'ATU de cohorte (ATUc). La rétrocession aux patients ambulatoires était autorisée.
L'évaluation médico-économique par la Commission de la Transparence (CT) a fait l'objet de 2 avis distincts, correspondant à chacune des indications de RYDAPT :
- avis du 13 juin 2018 : service médical rendu (SMR) important dans l'indication LAM, et amélioration du SMR mineure (ASMR IV) ;
- avis du 27 juin 2018 : SMR faible dans le traitement des mastocytoses et de la LM, sans ASMR (ASMR V).
RYDAPT en pratique
Le traitement par RYDAPT doit être initié par un médecin expérimenté dans l'utilisation des traitements anticancéreux.
Posologie recommandée dans le traitement de la LAM
Chez les patients présentant une LAM, la mutation du gène FLT3 (duplication interne en tandem [ITD] ou domaine tyrosine kinase [TKD]) doit être confirmée au moyen d'un test validé avant le début du traitement par midostaurine.
La dose recommandée est de 50 mg 2 fois par jour (2 capsules molles 2 fois par jour), à environ 12 heures d'intervalle.
Le schéma d'administration tient compte de la phase de traitement de chimiothérapie :
- administration aux jours 8 à 21 des cycles de chimiothérapie d'induction et de consolidation (J8 à J21),
- administration tous les jours comme traitement d'entretien en monothérapie, pour les patients en rémission complète, jusqu'à la survenue d'une rechute pour une durée maximale de 12 cycles de 28 jours chacun.
Chez les patients qui vont recevoir une greffe de cellules souches hématopoïétiques (CSH), le traitement doit être interrompu 48 heures avant de débuter le protocole de conditionnement de la greffe.
Posologie recommandée dans le traitement des mastocytoses
Dans le traitement des mastocytoses et de la LM, la posologie recommandée en midostaurine est de 100 mg 2 fois par jour, soit 4 capsules molles de 25 mg 2 fois par jour.
Administration avec de la nourriture
Les capsules molles de RYDAPT doivent être administrées avec de la nourriture, afin d'améliorer l'absorption de la midostaurine (cf. Encadré 1).
Encadré 1 - RYDAPT et nourriture, une interaction positive (extrait du RCP - Rubrique Interactions médicamenteuses)
| Chez les sujets sains, l'absorption de la midostaurine (ASC) était augmentée de 22 % en moyenne lorsque RYDAPT était co-administré avec un repas standard, et de 59 % en moyenne lors d'une co-administration avec un repas riche en matières grasses. Le pic de concentration de la midostaurine (Cmax) était diminué de 20 % avec un repas standard et de 27 % avec un repas riche en matières grasses par rapport à un estomac vide. |
Un traitement antiémétique peut être administré à titre préventif, conformément aux pratiques médicales locales et selon la tolérance du patient.
Surveillance des patients sous RYDAPT
Dans les deux indications de RYDAPT, un ajustement de dose peut être nécessaire, ou une suspension ou un arrêt définitif du traitement en fonction de la sévérité des effets indésirables. Les recommandations d'ajustement ou d'interruption sont précisées dans 2 tableaux au sein de la monographie VIDAL de RYDAPT - Rubrique Posologie et mode d'administration.
La surveillance des patients traités par RYDAPT porte sur :
- l'intervalle QTc à l'ECG : cette surveillance est à envisager lorsque RYDAPT est administré en association avec des médicaments qui sont susceptibles de prolonger l'intervalle QTc ;
- la détection de signes cliniques et symptômes évoquant une infection ou une toxicité pulmonaire.
Éviter les inhibiteurs du CYP3A4
L'utilisation concomitante de la midostaurine avec des médicaments inhibiteurs puissants du CYP3A4 doit être prudente (si elle s'avère nécessaire), car cette association expose à une augmentation de la concentration plasmatique de la midostaurine (et une augmentation du risque d'effets secondaires), en particulier lors d'une initiation ou d'une reprise du traitement par midostaurine.
Les médicaments concernés sont notamment les antifongiques (kétoconazole, etc.), certains antiviraux (ritonavir, etc.), les antibiotiques de la famille des macrolides (clarithromycine, etc.) et la néfazodone (non commercialisée en France).
Un test de grossesse avant d'initier le traitement
La fœtotoxicité de la midostaurine a été démontrée chez l'animal.
La réalisation d'un test de grossesse dans les 7 jours précédant le début du traitement par RYDAPT est conseillée.
Une contraception efficace doit être mise en place chez les femmes en âge de procréer au cours du traitement et pendant au moins 4 mois après l'arrêt de RYDAPT.
Faute de données pertinentes sur l'interaction midostaurine/contraceptifs hormonaux et sur une éventuelle réduction de l'efficacité contraceptive, les femmes utilisant des contraceptifs hormonaux doivent utiliser en plus une méthode contraceptive de barrière.
Identité administrative
- Liste I
- Prescription hospitalière, réservée aux spécialistes en hématologie, en oncologie, aux médecins compétents en maladies du sang ou en cancérologie, aux spécialistes en dermatologie ou en médecine interne
- Médicament à surveillance particulière
- Boîte de 56, CIP 3400930129821, prix public TTC = 6 014,35 euros
- Boite de 112, CIP 3400930113608, prix public TTC = 11 885,10 euros
- Remboursable à 100 % (Journal officiel du 4 décembre 2020 - texte 35)
- Agrément aux collectivités (Journal officiel du 4 décembre 2020 - texte 36)
- Laboratoire Novartis Pharma
Pour aller plus loin
Avis de la Commission de la Transparence - RYDAPT et leucémie aiguë myéloïde (HAS, 13 juin 2018)
Avis de la Commission de la Transparence - RYDAPT et mastocytose (HAS, 27 juin 2018)
Pour aller plus loin
Consultez les monographies VIDAL
Consultez les VIDAL Recos
Sources
Pour recevoir gratuitement toute l’actualité par mail Je m'abonne !

 6 minutes
6 minutes Ajouter un commentaire
Ajouter un commentaire





Commentaires
Cliquez ici pour revenir à l'accueil.