
Les femmes enceintes ne doivent en aucun cas prendre un médicament ni arrêter ou modifier un traitement qui lui a été prescrit sans en avoir préalablement parlé avec son médecin (illustration).
L'Agence du médicament (ANSM) a diffusé mercredi 24 avril 2019 un rapport sur le risque de malformations et de troubles neuro-développementaux associé aux antiépileptiques commercialisés en France, en cas d'exposition in utero.
Cette analyse s'appuie sur l'ensemble des données disponibles au 1er septembre 2015, issues de la littérature scientifique et des données de pharmacovigilance des titulaires des médicaments.
Les nouvelles études publiées entre septembre 2015 et juin 2018 (période de revue des données et de rédaction du rapport) ont également été prises en compte lorsqu'elles apportaient des éléments supplémentaires.
Cette analyse complète les travaux déjà réalisés sur le valproate et les risques associés à une exposition in utero (Cf. Exposition in utero à l'acide valproïque et aux autres traitements de l'épilepsie et des troubles bipolaires et risque de malformations congénitales majeures (MCM) en France. Rapport de l'ANSM, juillet 2017)
Malformation congénitale : 5 substances associées à un sur-risque
Les données relatives au risque de malformation sont les plus fournies : leur analyse a permis de hiérarchiser une partie des antiépileptiques en fonction du niveau de risque correspondant à une augmentation de la fréquence globale de malformations par rapport à la fréquence observée en population générale (Cf. Figure 1).
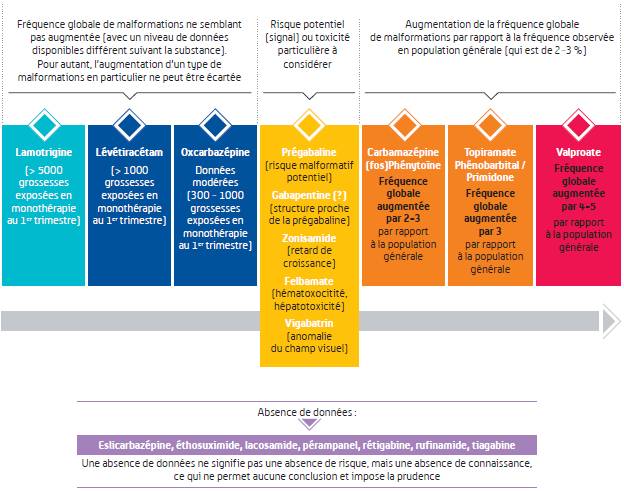
Le valproate (DEPAKINE, DEPAKINE CHRONO, DEPAMIDE, MICROPAKINE LP, DEPAKOTE, et génériques) est l'antiépileptique le plus à risque de malformations congénitales, avec une fréquence multipliée par 4 à 5 par rapport à la population générale.
Parmi les 21 substances antiépileptiques analysées, cinq ont été identifiées comme étant à risque accru :
- le topiramate (EPITOMAX et génériques), le phénobarbital (GARDENAL), la primidone (MYSOLINE) : fréquence multipliée par 3,
- la carbamazépine (TEGRETOL et génériques) et la (fos) phénytoïne (DI-HYDAN, DILANTIN, DIPHANTOINE, PRODILANTIN) : fréquence multipliée par 2 à 3.
En revanche, les données ne montrent pas d'augmentation de la fréquence des malformations congénitales pour la lamotrigine (LAMICTAL et génériques), le lévétiracétam (KEPPRA et génériques, LEVIDCEN) et l'oxcarbazépine (TRILEPTAL et génériques).
Topiramate et prégabaline : "particulièrement préoccupants"
Les auteurs du rapport soulignent le profil de sécurité d'emploi "particulièrement préoccupant" de deux substances antiépileptiques, en raison de leur profil à la fois de risque et d'utilisation : le topiramate (EPITOMAX et génériques) et la prégabaline (LYRICA et génériques).
Le topiramate associe, en effet, une tératogénicité avérée, comme vu sur la Figure 1 (en particulier risque accru de fentes orales et d'hypospadias), et un risque potentiel de troubles neurodéveloppementaux (signal).
Les auteurs du rapport précisent que les femmes sont les plus exposées à cet antiépileptique (environ 3/4 des patients de 15 à 49 ans), leur niveau d'exposition est élevé (environ 30 000 femmes en âge de procréer traitées en 2015), et en augmentation au cours du temps et des usages hors AMM identifiés "notamment à des fins amaigrissantes et dans le trouble bipolaires".
La prégabaline (LYRICA et générique) et la gabapentine (NEURONTIN), dont la structure est proche, cumulent pour leur part un risque potentiel de malformation congénitale (Cf. Figure 1) et un niveau d'exposition très élevé (de l'ordre de 150 000 femmes en âge de procréer traitées en 2016), en augmentation au cours du temps, dans des indications multiples et des usages hors AMM identifiés, notamment dans les douleurs neuropathiques.
L'ANSM appelle donc à la vigilance au regard du risque malformatif potentiel et de la prescription importante en France de ces deux antiépileptiques.
Absence de données pour les autres antiépileptiques
Faute de données, les conclusions relatives au risque de malformation ne concernent pas l'eslicarbazépine (ZEBINIX), l'éthosuximide (ZARONTIN), le lacosamide (VIMPAT), le pérampanel (FYCOMPA), la rétigabine (TROBALT, en arrêt de commercialisation), le rufinamide (INOVELON) et la tiagabine (GABITRIL).
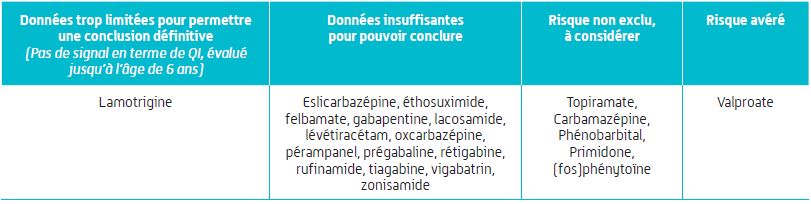
Pas de conclusions sur le risque de troubles neuro-développementaux
Pour le valproate, le risque de troubles neuro-développementaux lié à une exposition in utero est avéré.
S'agissant des autres anti-épileptiques, "les données sur ce type de risque restent actuellement limitées" (Cf. Figure 2).
Des mesures complémentaires à venir
Cette analyse servira de base à l'élaboration de mesures complémentaires de réduction des risques liés à l'exposition in utero aux antiépileptiques.
Un comité d'experts indépendants (CSST) doit se réunir le 14 mai 2019.
En attendant, les professionnels de santé sont invités à rappeler aux patientes traitées par un anti-épileptique de :
- ne pas arrêter ni modifier le traitement sans avis médical,
- consulter leur prescripteur en cas de désir de grossesse ou de grossesse en cours (Cf. Figure 3).
Figure 3 - Information destinée aux patientes traitées par anti-épileptique

Pour aller plus loin
Antiépileptiques au cours de la grossesse : Etat actuel des connaissances sur les risques de malformations et de troubles neuro-développementaux - Point d'information (ANSM, 24 avril 2019)
Synthèse du rapport Antiépileptiques au cours de la grossesse : Etat actuel des connaissances sur le risque de malformation et de troubles neuro-développementaux (ANSM, 24 avril 2019)
Rapport Antiépileptiques au cours de la grossesse : Etat actuel des connaissances sur le risque de malformations et de troubles neuro-développementaux (ANSM, 24 avril 2019)
Sur VIDAL.fr
Valproate : interdiction chez toutes les patientes enceintes ou en âge de procréer, sauf exception (13 juin 2018)
Grossesse : les boîtes de médicaments à risque arborent le pictogramme "femmes enceintes" (16 octobre 2017)
Valproate et grossesse : un risque de malformations congénitales majeures 2 à 4 fois supérieur (24 avril 2017)
Epilepsie et grossesse : pictogramme d'alerte sur les boîtes de valproate et dérivés (6 mars 2017)
Valproate et dérivés : une carte patiente à remettre systématiquement (15 février 2017)
Médicaments à base de valproate et dérivés : renforcement des conditions de prescription et de délivrance (27 mai 2015)
- CARBAMAZEPINE SANDOZ LP 200 mg cp enr séc LP
- CARBAMAZEPINE SANDOZ LP 400 mg cp enr séc LP
- CARBAMAZEPINE VIATRIS LP 200 mg cp séc LP
- CARBAMAZEPINE VIATRIS LP 400 mg cp séc LP
- DI-HYDAN 100 mg cp séc
- DILANTIN 250 mg/5 ml sol inj
- EPITOMAX 100 mg cp pellic
- EPITOMAX 15 mg gél
- EPITOMAX 200 mg cp pellic
- EPITOMAX 25 mg gél
- EPITOMAX 50 mg cp pellic
- EPITOMAX 50 mg gél
- FYCOMPA 10 mg cp pellic
- FYCOMPA 12 mg cp pellic
- FYCOMPA 2 mg cp pellic
- FYCOMPA 4 mg cp pellic
- FYCOMPA 6 mg cp pellic
- FYCOMPA 8 mg cp pellic
- GABAPENTINE ARROW 600 mg cp pellic
- GABAPENTINE ARROW 800 mg cp pellic
- GABAPENTINE ARROW GENERIQUES 100 mg gél
- GABAPENTINE ARROW GENERIQUES 300 mg gél
- GABAPENTINE ARROW GENERIQUES 400 mg gél
- GABAPENTINE BIOGARAN 100 mg gél
- GABAPENTINE BIOGARAN 300 mg gél
- GABAPENTINE BIOGARAN 400 mg gél
- GABAPENTINE BIOGARAN 600 mg cp pellic
- GABAPENTINE BIOGARAN 800 mg cp pellic
- GABAPENTINE CRISTERS 400 mg gél
- GABAPENTINE EG LABO 100 mg gél
- GABAPENTINE EG LABO 300 mg gél
- GABAPENTINE EG LABO 400 mg gél
- GABAPENTINE EG LABO 600 mg cp pellic
- GABAPENTINE EG LABO 800 mg cp pellic
- GABAPENTINE EVOLUGEN 100 mg gél
- GABAPENTINE EVOLUGEN 300 mg gél
- GABAPENTINE EVOLUGEN 400 mg gél
- GABAPENTINE MYLAN 600 mg cp pellic
- GABAPENTINE MYLAN 800 mg cp pellic
- GABAPENTINE RANBAXY 400 mg gél
- GABAPENTINE SANDOZ 600 mg cp pellic
- GABAPENTINE SANDOZ 800 mg cp pellic
- GABAPENTINE TEVA 100 mg gél
- GABAPENTINE TEVA 300 mg gél
- GABAPENTINE TEVA 400 mg gél
- GABAPENTINE TEVA SANTE 600 mg cp pellic
- GABAPENTINE TEVA SANTE 800 mg cp pellic
- GABAPENTINE VIATRIS 100 mg gél
- GABAPENTINE VIATRIS 300 mg gél
- GABAPENTINE VIATRIS 400 mg gél
- GABAPENTINE VIATRIS GENERIQUES 100 mg gél
- GABAPENTINE VIATRIS GENERIQUES 300 mg gél
- GABAPENTINE VIATRIS GENERIQUES 400 mg gél
- GABAPENTINE VIATRIS GENERIQUES 600 mg cp pellic séc
- GABAPENTINE VIATRIS GENERIQUES 800 mg cp pellic séc
- GABAPENTINE ZENTIVA 100 mg gél
- GABAPENTINE ZENTIVA 300 mg gél
- GABAPENTINE ZENTIVA 400 mg gél
- GABAPENTINE ZENTIVA 600 mg cp pellic
- GABAPENTINE ZENTIVA 800 mg cp pellic
- GABAPENTINE ZYDUS 100 mg gél
- GABAPENTINE ZYDUS 300 mg gél
- GABAPENTINE ZYDUS 400 mg gél
- GABITRIL 10 mg cp pellic
- GABITRIL 15 mg cp pellic
- GABITRIL 5 mg cp pellic
- GARDENAL 10 mg cp
- GARDENAL 100 mg cp
- GARDENAL 200 mg/4 ml pdre/solv p sol inj
- GARDENAL 40 mg/2 ml pdre/solv p sol inj
- GARDENAL 50 mg cp
- INOVELON 100 mg cp pellic
- INOVELON 200 mg cp pellic
- INOVELON 40 mg/ml susp buv
- INOVELON 400 mg cp pellic
- KEPPRA 100 mg/ml sol buv
- KEPPRA 100 mg/ml sol diluer p perf
- KEPPRA 1000 mg cp pellic
- KEPPRA 250 mg cp pellic
- KEPPRA 500 mg cp pellic
- LAMICTAL 100 mg cp dispers/croquer
- LAMICTAL 2 mg cp dispers/croquer
- LAMICTAL 200 mg cp dispers/croquer
- LAMICTAL 25 mg cp dispers/croquer
- LAMICTAL 5 mg cp dispers/croquer
- LAMICTAL 50 mg cp dispers/croquer
- LAMOTRIGINE ARROW LAB 100 mg cp disp/croquer
- LAMOTRIGINE ARROW LAB 200 mg cp disp/croquer
- LAMOTRIGINE ARROW LAB 25 mg cp disp/croquer
- LAMOTRIGINE ARROW LAB 50 mg cp disp/croquer
- LAMOTRIGINE BIOGARAN 100 mg cp dispers
- LAMOTRIGINE BIOGARAN 200 mg cp dispers
- LAMOTRIGINE BIOGARAN 25 mg cp dispers
- LAMOTRIGINE BIOGARAN 50 mg cp dispers
- LAMOTRIGINE EG 100 mg cp à croquer/dispers
- LAMOTRIGINE EG 200 mg cp à croquer/dispers
- LAMOTRIGINE EG 25 mg cp à croquer/dispers
- LAMOTRIGINE SANDOZ 100 mg cp dispers
- LAMOTRIGINE TEVA 100 mg cp à croquer/dispers
- LAMOTRIGINE TEVA 200 mg cp à croquer/dispers
- LAMOTRIGINE TEVA 25 mg cp à croquer/dispers
- LAMOTRIGINE TEVA 5 mg cp à croquer/dispers
- LAMOTRIGINE TEVA 50 mg cp à croquer/dispers
- LAMOTRIGINE VIATRIS 100 mg cp dispers
- LAMOTRIGINE VIATRIS 25 mg cp dispers
- LAMOTRIGINE VIATRIS 50 mg cp dispers
- LEVETIRACETAM ACCORD 1000 mg cp pellic
- LEVETIRACETAM ACCORD 250 mg cp pellic
- LEVETIRACETAM ACCORD 500 mg cp pellic
- LEVETIRACETAM ALTER 500 mg cp pellic
- LEVETIRACETAM ARROW 100 mg/ml sol buv
- LEVETIRACETAM ARROW 100 mg/ml sol diluer p perf
- LEVETIRACETAM ARROW LAB 1000 mg cp pellic séc
- LEVETIRACETAM ARROW LAB 250 mg cp pellic séc
- LEVETIRACETAM ARROW LAB 500 mg cp pellic séc
- LEVETIRACETAM BIOGARAN 1000 mg cp pellic séc
- LEVETIRACETAM BIOGARAN 250 mg cp pellic séc
- LEVETIRACETAM BIOGARAN 500 mg cp pellic séc
- LEVETIRACETAM CRISTERS 1000 mg cp pellic séc
- LEVETIRACETAM CRISTERS 250 mg cp pellic séc
- LEVETIRACETAM CRISTERS 500 mg cp pellic séc
- LEVETIRACETAM EG 1000 mg cp pellic
- LEVETIRACETAM EG 250 mg cp pellic
- LEVETIRACETAM EG 500 mg cp pellic
- LEVETIRACETAM EVOLUGEN 500 mg cp pellic séc
- LEVETIRACETAM HOSPIRA 100 mg/ml sol diluer p perf
- LEVETIRACETAM KRKA 1000 mg cp pellic séc
- LEVETIRACETAM KRKA 250 mg cp pellic
- LEVETIRACETAM KRKA 500 mg cp pellic séc
- LEVETIRACETAM SANDOZ 100 mg/ml sol buv
- LEVETIRACETAM SANDOZ 1000 mg cp pellic séc
- LEVETIRACETAM SANDOZ 250 mg cp pellic séc
- LEVETIRACETAM SANDOZ 500 mg cp pellic séc
- LEVETIRACETAM STRAGEN 500 mg/100 ml sol p perf
- LEVETIRACETAM SUN 100 mg/ml sol diluer p perf
- LEVETIRACETAM TEVA 1000 mg cp pellic
- LEVETIRACETAM TEVA 250 mg cp pellic
- LEVETIRACETAM TEVA 500 mg cp pellic
- LEVETIRACETAM VIATRIS 100 mg/ml sol buv
- LEVETIRACETAM VIATRIS 100 mg/ml sol diluer p perf
- LEVETIRACETAM VIATRIS 1000 mg cp pellic
- LEVETIRACETAM VIATRIS 250 mg cp pellic
- LEVETIRACETAM VIATRIS 500 mg cp pellic
- LEVETIRACETAM ZENTIVA 1000 mg cp pellic
- LEVETIRACETAM ZENTIVA 250 mg cp pellic
- LEVETIRACETAM ZENTIVA 500 mg cp pellic
- LEVETIRACETAM ZYDUS 1000 mg cp pellic
- LEVETIRACETAM ZYDUS 250 mg cp pellic
- LEVETIRACETAM ZYDUS 500 mg cp pellic
- LEVIDCEN 1000 mg glé enr en sachet
- LEVIDCEN 250 mg glé enr en sachet
- LEVIDCEN 500 mg glé enr en sachet
- LEVIDCEN 750 mg glé enr en sachet
- LYRICA 100 mg gél
- LYRICA 150 mg gél
- LYRICA 20 mg/ml sol buv
- LYRICA 200 mg gél
- LYRICA 25 mg gél
- LYRICA 300 mg gél
- LYRICA 50 mg gél
- LYRICA 75 mg gél
- MYSOLINE 250 mg cp séc
- NEURONTIN 100 mg gél
- NEURONTIN 300 mg gél
- NEURONTIN 300 mg gél [ES1]
- NEURONTIN 300 mg gél [ES2]
- NEURONTIN 400 mg gél
- NEURONTIN 400 mg gél [ES1]
- NEURONTIN 600 mg cp pellic
- NEURONTIN 600 mg cp pellic [ES1]
- NEURONTIN 800 mg cp pellic
- OXCARBAZEPINE SANDOZ 150 mg cp pellic
- OXCARBAZEPINE SANDOZ 300 mg cp pellic
- OXCARBAZEPINE SANDOZ 600 mg cp pellic
- OXCARBAZEPINE VIATRIS 150 mg cp pellic
- OXCARBAZEPINE VIATRIS 300 mg cp pellic
- OXCARBAZEPINE VIATRIS 600 mg cp pellic
- PHENOBARBITAL RICHARD 100 mg cp séc
- PREGABALINE ALTER 150 mg gél
- PREGABALINE ALTER 75 mg gél
- PREGABALINE ARROW LAB 75 mg gél
- PREGABALINE BIOGARAN 100 mg gél
- PREGABALINE BIOGARAN 150 mg gél
- PREGABALINE BIOGARAN 200 mg gél
- PREGABALINE BIOGARAN 25 mg gél
- PREGABALINE BIOGARAN 300 mg gél
- PREGABALINE BIOGARAN 50 mg gél
- PREGABALINE BIOGARAN 75 mg gél
- PREGABALINE EG LABO 100 mg gél
- PREGABALINE EG LABO 150 mg gél
- PREGABALINE EG LABO 200 mg gél
- PREGABALINE EG LABO 25 mg gél
- PREGABALINE EG LABO 300 mg gél
- PREGABALINE EG LABO 50 mg gél
- PREGABALINE EVOLUGEN 100 mg gél
- PREGABALINE EVOLUGEN 150 mg gél
- PREGABALINE EVOLUGEN 200 mg gél
- PREGABALINE EVOLUGEN 25 mg gél
- PREGABALINE EVOLUGEN 300 mg gél
- PREGABALINE EVOLUGEN 50 mg gél
- PREGABALINE EVOLUGEN 75 mg gél
- PREGABALINE HCS 100 mg gél
- PREGABALINE HCS 150 mg gél
- PREGABALINE HCS 200 mg gél
- PREGABALINE HCS 25 mg gél
- PREGABALINE HCS 300 mg gél
- PREGABALINE HCS 50 mg gél
- PREGABALINE HCS 75 mg gél
- PREGABALINE PFIZER 100 mg gél
- PREGABALINE PFIZER 150 mg gél
- PREGABALINE PFIZER 200 mg gél
- PREGABALINE PFIZER 25 mg gél
- PREGABALINE PFIZER 300 mg gél
- PREGABALINE PFIZER 50 mg gél
- PREGABALINE PFIZER 75 mg gél
- PREGABALINE SANDOZ 100 mg gél
- PREGABALINE SANDOZ 150 mg gél
- PREGABALINE SANDOZ 200 mg gél
- PREGABALINE SANDOZ 25 mg gél
- PREGABALINE SANDOZ 300 mg gél
- PREGABALINE SANDOZ 50 mg gél
- PREGABALINE SANDOZ 75 mg gél
- PREGABALINE TEVA SANTE 100 mg gél
- PREGABALINE TEVA SANTE 150 mg gél
- PREGABALINE TEVA SANTE 200 mg gél
- PREGABALINE TEVA SANTE 25 mg gél
- PREGABALINE TEVA SANTE 300 mg gél
- PREGABALINE TEVA SANTE 50 mg gél
- PREGABALINE TEVA SANTE 75 mg gél
- PREGABALINE VIATRIS 100 mg gél
- PREGABALINE VIATRIS 150 mg gél
- PREGABALINE VIATRIS 200 mg gél
- PREGABALINE VIATRIS 25 mg gél
- PREGABALINE VIATRIS 300 mg gél
- PREGABALINE VIATRIS 50 mg gél
- PREGABALINE VIATRIS 75 mg gél
- PREGABALINE ZENTIVA 100 mg gél
- PREGABALINE ZENTIVA 150 mg gél
- PREGABALINE ZENTIVA 200 mg gél
- PREGABALINE ZENTIVA 25 mg gél
- PREGABALINE ZENTIVA 300 mg gél
- PREGABALINE ZENTIVA 50 mg gél
- PREGABALINE ZENTIVA 75 mg gél
- PREGABALINE ZENTIVA K.S. 100 mg gél
- PREGABALINE ZENTIVA K.S. 150 mg gél
- PREGABALINE ZENTIVA K.S. 200 mg gél
- PREGABALINE ZENTIVA K.S. 25 mg gél
- PREGABALINE ZENTIVA K.S. 300 mg gél
- PREGABALINE ZENTIVA K.S. 50 mg gél
- PREGABALINE ZENTIVA K.S. 75 mg gél
- PREGABALINE ZYDUS 100 mg gél
- PREGABALINE ZYDUS 150 mg gél
- PREGABALINE ZYDUS 200 mg gél
- PREGABALINE ZYDUS 25 mg gél
- PREGABALINE ZYDUS 300 mg gél
- PREGABALINE ZYDUS 50 mg gél
- PREGABALINE ZYDUS 75 mg gél
- PRODILANTIN 75 mg/ml sol inj
- TEGRETOL 20 mg/ml susp buv
- TEGRETOL 200 mg cp séc
- TEGRETOL LP 200 mg cp pellic séc LP
- TEGRETOL LP 400 mg cp pellic séc LP
- TOPIRAMATE ACCORD 100 mg cp pellic
- TOPIRAMATE ACCORD 200 mg cp pellic
- TOPIRAMATE ACCORD 25 mg cp pellic
- TOPIRAMATE ACCORD 50 mg cp pellic
- TOPIRAMATE ARROW GENERIQUES 100 mg cp pellic
- TOPIRAMATE ARROW GENERIQUES 200 mg cp pellic
- TOPIRAMATE ARROW GENERIQUES 50 mg cp pellic
- TOPIRAMATE BGR 100 mg cp pellic
- TOPIRAMATE BGR 200 mg cp pellic
- TOPIRAMATE BGR 50 mg cp pellic
- TOPIRAMATE SANDOZ 100 mg cp pellic
- TOPIRAMATE SANDOZ 200 mg cp pellic
- TOPIRAMATE SANDOZ 50 mg cp pellic
- TOPIRAMATE VIATRIS 100 mg cp pellic
- TOPIRAMATE VIATRIS 200 mg cp pellic
- TRILEPTAL 150 mg cp pellic
- TRILEPTAL 300 mg cp pellic
- TRILEPTAL 60 mg/ml susp buv
- TRILEPTAL 600 mg cp pellic
- VIMPAT 10 mg/ml sirop
- VIMPAT 10 mg/ml sol p perf
- VIMPAT 100 mg cp pellic
- VIMPAT 150 mg cp pellic
- VIMPAT 200 mg cp pellic
- VIMPAT 50 mg cp pellic
- ZARONTIN 250 mg/5 ml sirop
- ZEBINIX 800 mg cp

 5 minutes
5 minutes Ajouter un commentaire
Ajouter un commentaire


Commentaires
Cliquez ici pour revenir à l'accueil.