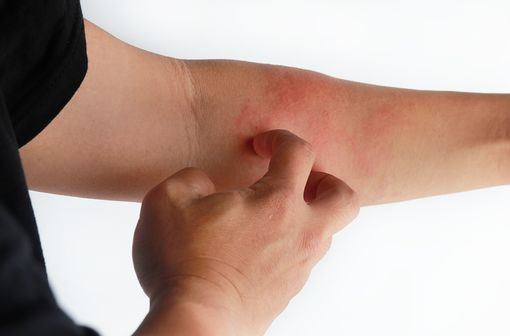
La dermatite atopique de lãadulte se manifeste, dans sa forme chronique, par des lésions cutanées érythémateuses dãétendue et dãintensité variables (illustration).
La prise en charge (remboursement en ville et agrément aux collectivités) d'OLUMIANT 2 mg et 4 mg comprimé pelliculé (baricitinib) est étendue au traitement de la dermatite atopique modérée à sévère de l'adulte qui nécessite un traitement systémique uniquement en cas d'échec, d'intolérance ou de contre-indication à la ciclosporine (cf. Encadrés 1 et 2).
Encadré 1 - Indications thérapeutiques d'OLUMIANT
|
Encadré 2 - Modalités de prise en charge d'OLUMIANT
Modalités de prescription et délivrance :
Taux de remboursement : 65 % |
Une prise en charge sous condition
Comme demandé par le laboratoire Lilly, le périmètre de prise en charge d'OLUMIANT dans la dermatite atopique est restreint par rapport à l'indication de l'AMM, puisqu'il pose une condition supplémentaire : échec, intolérance ou contre-indication à la ciclosporine.
L'évaluation médico-économique d'OLUMIANT en dermatologie a fait l'objet d'un avis de la Commission de la Transparence (CT) publié le 3 février 2021.
Dans cet avis, la CT attribue :
- un SMR faible à OLUMIANT. S'appuyant sur les données des études cliniques disponibles (cf. Encadré 3), la CT souligne les effets très modestes observés avec le baricitinib versus placebo chez les patients adultes souffrant de dermatite atopique ;
- un SMR insuffisant après échec des traitements topiques, chez les patients naïfs de ciclosporine, faute de données comparatives.
Encadré 3 - Les études cliniques ayant évalué l'efficacité du baricitinib dans le traitement de la dermatite atopique
|
OLUMIANT en dermatologie : en pratique
La dose recommandée d'OLUMIANT est de 4 mg 1 fois par jour.
Une dose réduite (2 mg 1 fois par jour) est envisagée pour certains patients :
- patients de 75 ans et plus,
- éventuellement, patients ayant des antécédents d'infections chroniques ou récurrentes,
- éventuellement, patients dont l'activité de la maladie est contrôlée durablement avec la dose de 4 mg 1 fois par jour et qui sont éligibles à une diminution de la dose.
OLUMIANT peut être utilisé avec ou sans corticoïde topique. Il est possible d'utiliser des inhibiteurs topiques de la calcineurine, mais ils doivent être réservés aux zones sensibles uniquement, telles que le visage, le cou, les zones intertrigineuses et les parties génitales.
Pour aller plus loin
Arrêté du 24 mars 2021 modifiant la liste des spécialités pharmaceutiques remboursables aux assurés sociaux - Fiche d'information thérapeutique d'OLUMIANT (Journal officiel du 31 mars 2021 - texte 24)
Arrêté du 24 mars 2021 modifiant la liste des spécialités pharmaceutiques agréées à l'usage des collectivités et divers services publics - OLUMIANT (Journal officiel du 31 mars 2021 - texte 25)
Avis de la Commission de la Transparence - OLUMIANT et dermatite atopique (HAS, 3 février 2021)
L'étude pivot (publiée)
(1) Simpson EL, Lacour JP, Spelman L, et al. Baricitinib in patients with moderate-to-severe atopic dermatitis and inadequate response to topical corticosteroids: results from two randomized monotherapy phase III trials [published online ahead of print, 2020 Jan 5]. Br J Dermatol. 2020 ; 10.1111

 4 minutes
4 minutes Ajouter un commentaire
Ajouter un commentaire





Commentaires
Cliquez ici pour revenir à l'accueil.