Chez l’enfant et l’adolescent, la RCH se manifeste par des formes potentiellement plus agressives que chez l’adulte, en raison d’une étendue de la pathologie plus importante (illustration @wikimedia).
La prise en charge (remboursement en ville et agrément aux collectivités) d'HUMIRA solution injectable 40 mg/0,4 mL et 80 mg/0,8 mL en seringue préremplie et stylo prérempli (adalimumab) est étendue au traitement de la rectocolite hémorragique (RCH) active, modérée à sévère, de l'enfant à partir de 6 ans et l'adolescent, en deuxième intention.
Jusqu'à présent, dans cette maladie inflammatoire chronique de l'intestin (MICI), le remboursement d'HUMIRA était limité au traitement de l'adulte.
Dans cette indication pédiatrique octroyée fin 2020, la Commission de la Transparence (CT) a attribué un service médical rendu (SMR) important à HUMIRA, sans amélioration du SMR (ASMR V).
Le schéma posologique (dose d'induction et dose d'entretien) est défini en fonction du poids du jeune patient.
HUMIRA est remboursable à 65 %, avec une ordonnance de médicament d'exception. La prescription est restreinte.
Les spécialités à base d'adalimumab HUMIRA solution injectable 40 mg/mL et 80 mg/0,8 mL en seringue préremplie et stylo prérempli (cf. Encadré 1) bénéficient d'une extension de remboursement et d'agrément aux collectivités dans :
- le traitement de la rectocolite hémorragique active (RCH), modérée à sévère chez les enfants et les adolescents à partir de 6 ans ayant eu une réponse inadéquate au traitement conventionnel, comprenant les corticoïdes et/ou la 6-mercaptopurine (6-MP) ou l'azathioprine (AZA), ou chez lesquels ces traitements sont mal tolérés ou contre-indiqués (cf. VIDAL Reco "Rectocolite hémorragique").
Encadré 1 - Spécialités d'HUMIRA bénéficiant d'une extension de prise en charge dans la rectocolite hémorragique pédiatrique (RCH)
|
HUMIRA a obtenu cette extension d'indication dans la RCH en pédiatrie en novembre 2020 (cf. Encadré 2). L'extension de prise en charge recommandée par la Commission de la Transparence (CT) couvre la totalité de l'indication de l'autorisation de mise sur le marché (AMM).
Jusqu'à présent, en France, la prise en charge d'HUMIRA dans la rectocolite hémorragique était limitée aux adultes.
Encadré 2 - Indications thérapeutiques d'HUMIRA, dans la rectocolite hémorragique (AMM)
Chez l'adulte
|
Chez l'enfant et l'adolescent
|
Les études cliniques disponibles
Dans son avis du 19 mai 2021, la CT a évalué l'efficacité et la tolérance d'HUMIRA dans cette extension d'indication sur la base principalement de deux études cliniques dont l'une est toujours en cours :
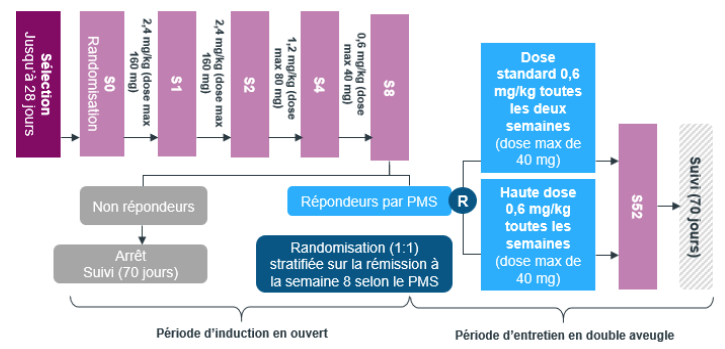
- l'étude de phase III (M11-290) multicentrique, randomisée, en double aveugle, sans groupe contrôle actif, comprenant une phase d'induction et une phase d'entretien pour le maintien de la rémission chez les patients répondeurs (à partir de la semaine 8).
- Cette étude a évalué l'efficacité et la tolérance de l'adalimumab, chez 93 enfants âgés de 4 ans et plus atteints d'une RCH active modérée à sévère en échec à un traitement par corticoïdes et/ou immunosuppresseurs.
- Elle a duré jusqu'à 66 semaines, mais le protocole a été modifié de façon importante en 2017 (amendement) [cf. Figure 1] ;
- Les co-critères de jugement principaux étaient :
- la proportion de patients (enfants et adolescents) en rémission clinique à S8 (définie par un score Mayo partiel [SMP] < 2 et aucun sous-score individuel > 1) dans la population ITT-E,
- et la proportion de patients répondeurs à S8 (selon le SMP) atteignant une rémission clinique à S52 (définie par un score Mayo < 2 et aucun sous-score individuel > 1) dans la population ITT modifiée (mITT-E) ;
- la phase d'extension, non comparative, ouverte, de l'étude M11-290 (M10-870), toujours en cours.
- L'objectif principal est d'évaluer le maintien de la réponse clinique et le profil de tolérance à long terme de l'adalimumab chez les enfants et adolescents (n = 55) ayant terminé l'étude M11-290 à la semaine 52.
- Il n'a pas été défini de critère de jugement principal, mais parmi les critères évalués figurent :
- la proportion de patients ayant une rémission clinique mesurée par le score Mayo partiel (SMP < 2 et absence de sous-score individuel > 1) ;
- la proportion de patients ayant une rémission selon le score Paediatric Ulcerative Colitis Activity Index (PUCAI < 10) ;
- les événements/effets indésirables.
- sur le premier co-critère principal : une rémission clinique a été obtenue chez 59,6% (28/47) des patients recevant la dose d'induction la plus élevée (I- HD) et chez 43,3% (13/30) de ceux recevant la dose d'induction standard (I-SD) ;
- sur le second co-critère principal : la rémission clinique a été atteinte par 14 patients (45,2%) du groupe haute dose d'entretien (M-HD) et par 9 patients (29,0%) du groupe de dose standard d'entretien (M-SD)
Sur la base des données disponible au moment de son évaluation, la CT a attribué à HUMIRA un service médical rendu (SMR) important, sans amélioration du SMR (ASMR V), dans l'indication RCH pédiatrique.
Cette conclusion est similaire à celle émise en 2012, lors de l'évaluation médico-économique d'HUMIRA dans la prise en charge de la RCH chez l'adulte (avis du 3 octobre 2012).
Elle a également pris en compte le profil d'efficacité et de tolérance établi de l'adalimumab chez l'adulte et dans d'autres indications pédiatriques, notamment la maladie de Crohn.
Selon les conclusions de la CT, la place d'HUMIRA dans la stratégie thérapeutique est celle d'une option thérapeutique de 2e intention dans le traitement de la RCH active, modérée à sévère chez les enfants et les adolescents à partir de 6 ans ayant eu une réponse inadéquate au traitement conventionnel, comprenant les corticoïdes et/ou la 6-MP ou l'AZA, ou chez lesquels ces traitements sont mal tolérés ou contre-indiqués.
HUMIRA présente l'intérêt potentiel d'être injecté par voie sous-cutanée (SC). Il représente une alternative à l'infliximab administré par voie intraveineuse (IV).
HUMIRA chez l'enfant atteint de RCH : posologie
La posologie recommandée d'HUMIRA chez les patients âgés de 6 à 17 ans atteints de RCH dépend du poids corporel (cf. Tableau I).
Tableau I - Posologie d'HUMIRA chez les enfants et les adolescents atteints de rectocolite hémorragique (extrait de la monographie VIDAL HUMIRA)
| Poids du patient | Dose d'induction | Dose d'entretien à partir de la semaine 4* |
| < 40 kg |
|
|
| > 40 kg |
|
|
Rappel sur les conditions de prescription d'HUMIRA
HUMIRA est un médicament d'exception et sa prescription doit être établie sur une ordonnance spécifique, en conformité avec la fiche d'information thérapeutique (FIT) publié le 14 décembre 2021 au Journal officiel.
HUMIRA est soumis à prescription initiale hospitalière.
La prescription initiale et le renouvellement sont réservés aux spécialistes en rhumatologie, pédiatrie, médecine interne, gastroentérologie et hépatologie, dermatologie et ophtalmologie.
Comme pour les autres indications prises en charge, HUMIRA est remboursable à 65 % dans la RCH pédiatrique.
Pour aller plus loin
Arrêté du 3 décembre 2021 modifiant la liste des spécialités pharmaceutiques remboursables aux assurés sociaux - Fiche d'information thérapeutique actualisée (Journal officiel du 14 décembre 2021 - texte 9)
Arrêté du 3 décembre 2021 modifiant la liste des spécialités pharmaceutiques agréées à l'usage des collectivités et divers services publics (Journal officiel du 14 décembre 2021 - texte 10)
Avis de la Commission de la Transparence - HUMIRA, rectocolite hémorragique pédiatrique (HAS, 19 mai 2021)

 6 minutes
6 minutes Ajouter un commentaire
Ajouter un commentaire





Commentaires
Cliquez ici pour revenir à l'accueil.