Deuxième cause de décès par cancer en France, le cancer colorectal se situe au 3e rang des cancers les plus fréquents chez l’homme et au 2e rang chez la femme (illustration).
Résumé
Les anticorps monoclonaux OPDIVO 10 mg/mL solution à diluer pour perfusion (nivolumab) et YERVOY 5 mg/mL solution à diluer pour perfusion (ipilimumab) utilisés en association sont désormais agréés aux collectivités dans le traitement du cancer colorectal métastatique avec une déficience du système de réparation des mésappariements de l'ADN ou une instabilité microsatellitaire élevée après une association antérieure de chimiothérapie à base de fluoropyrimidine.
À la différence de l'indication de l'autorisation de mise sur le marché (AMM), cette prise en charge ne s'applique qu'aux patients n'ayant pas reçu d'immunothérapie antérieure.
Les anticorps monoclonaux OPDIVO 10 mg/mL solution à diluer pour perfusion (nivolumab) et YERVOY 5 mg/mL solution à diluer pour perfusion (ipilimumab) utilisés en association sont désormais agréés aux collectivités dans le traitement du cancer colorectal métastatique avec une déficience du système de réparation des mésappariements de l'ADN ou une instabilité microsatellitaire élevée après une association antérieure de chimiothérapie à base de fluoropyrimidine.
À la différence de l'indication de l'autorisation de mise sur le marché (AMM), cette prise en charge ne s'applique qu'aux patients n'ayant pas reçu d'immunothérapie antérieure.
La prise en charge des immunothérapies OPDIVO 10 mg/mL solution à diluer pour perfusion (nivolumab, anticorps monoclonal anti-PD-1) et YERVOY 5 mg/mL solution à diluer pour perfusion (ipilimumab, anticorps monoclonal anti-CTLA4) est étendue, dans le cadre de l'agrément aux collectivités, au traitement du cancer colorectal métastatique :
- avec une déficience du système de réparation des mésappariements de l'ADN
- ou une instabilité microsatellitaire élevée après une association antérieure de chimiothérapie à base de fluoropyrimidine,
- uniquement chez les patients n'ayant pas reçu d'immunothérapie antérieure (cf. VIDAL Reco "Cancer colorectal").
Cette extension de prise en charge s'applique à l'ensemble des présentations d'OPDIVO et de YERVOY actuellement commercialisées en France (cf. Encadré 1).
Encadré 1 - Gammes OPDIVO et YERVOY en détail
|
À propos de l'indication "Cancer colorectal"
OPDIVO et YERVOY ont reçu l'extension d'indication dans le cancer colorectal métastatique, en association, en juin dernier (cf. Encadré 2).
Encadré 2 - Association OPDIVO/YERVOY : indication de l'AMM - Cancer colorectal
Cancer colorectal avec déficience du système de réparation des mésappariements de l'ADN (dMMR) ou instabilité microsatellitaire élevée (MSI-H) :
|
Dans le traitement du cancer colorectal métastatique, OPDIVO et YERVOY en association ont bénéficié d'une autorisation temporaire d'utilisation de cohorte (ATUc) de mai à octobre 2021, chez les patients n'ayant pas reçu d'immunothérapie et présentant un score ECOG de 0 ou 1.
Une demande d'accès précoce a été déposée, mais refusée en septembre 2021 par la Haute Autorité de Santé (HAS) (avis du 22 septembre 2021).
NB. Une autorisation d'accès précoce a été octroyée le 23 septembre 2021 à l'association OPDIVO 10 mg/mL et YERVOY 5 mg/mL dans le traitement des patients adultes atteints d'un mésothéliome pleural malin non résécable.
Un périmètre de prise en charge restreint aux patients non précédemment traités par immunothérapie
À la différence de l'autorisation de mise sur le marché (AMM), le périmètre de prise en charge accordé dans le traitement du cancer colorectal métastatique n'inclut que les patients n'ayant pas reçu d'immunothérapie antérieure.
Cette restriction est conforme à l'avis de la Commission de la Transparence émis le 3 novembre 2021, dans lequel l'association OPDIVO/YERVOY a reçu :
- un service médical rendu (SMR) modéré uniquement chez les patients n'ayant pas reçu d'immunothérapie antérieure. La population cible a été estimée à environ 464 patients par an ;
- un SMR insuffisant dans le traitement du cancer colorectal chez les patients ayant reçu une immunothérapie antérieure.
À l'appui de son avis, la CT a analysé les résultats de l'étude de phase 2 non comparative CHECKMATE 142, conduite auprès de 119 patients ayant déjà reçu une chimiothérapie à base de fluoropyrimidine.
L'objectif était d'estimer le taux de réponse objective (évalué par l'investigateur) chez des patients adultes atteints d'un cancer colorectal métastatique avec une déficience du système de réparation des mésappariements de l'ADN ou une instabilité microsatellitaire élevée, et traités par l'association OPDIVO/YERVOY.
Le critère de jugement principal était le taux de réponse objective évalué par l'investigateur (étude en ouvert) selon les critères RECIST 1.1 et défini comme la proportion de patients ayant une réponse complète ou partielle.
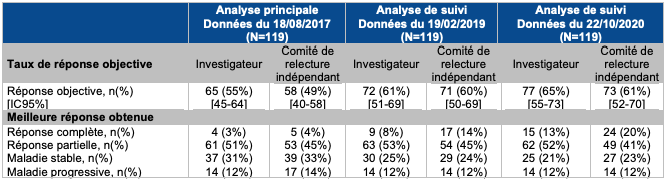
Le taux de réponse objective évaluée par l'investigateur a été (cf. Tableau I):
- de 55 % [IC95 % : 45-64],
- supérieur au seuil de 30 % défini a priori. Il s'agissait d'une réponse complète pour 3 % des patients.
Tableau I - Résultats du taux de réponse objective dans l'étude CHECKMATE 142 (évaluation par l'investigateur et par un comité de relecture indépendant)
La CT note par ailleurs le profil de tolérance de ce traitement combiné, marqué par :
- une incidence des événements indésirables (EI) graves rapportée chez plus de la moitié des patients (55 %) ;
- une incidence des EI de grades > 3 chez près deux tiers des patients (62%).
Place de OPDIVO/YERVOY dans la stratégie thérapeutique du cancer colorectal : une réévaluation en prévision
La CT a jugé que la place de la bithérapie OPDIVO/YERVOY dans la stratégie thérapeutique "ne peut pas être précisée vis-à-vis des protocoles de chimiothérapie utilisés en deuxième ligne et au-delà, du fait de l'absence de donnée comparative directe et de l'absence de comparaison indirecte de bonne qualité méthodologique".
Elle prévoit une réévaluation de cet avis d'ici quelques mois, afin d'intégrer des résultats d'une phase III en cours et attendus en 2023-début 2024.
OPDIVO/YERVOY dans le traitement du cancer colorectal : recommandations posologiques
Dans le traitement du cancer colorectal dMMR ou MSI-H, la dose recommandée est de 1 mg/kg d'ipilimumab (YERVOY) en association à 3 mg/kg de nivolumab (OPDIVO), administrée par voie intraveineuse (IV) toutes les 3 semaines pour les 4 premières doses.
Dans la seconde phase qui fait suite l'instauration de traitement en bithérapie, le nivolumab en monothérapie est administré en IV à 240 mg toutes les 2 semaines (cf. Tableau II). Au cours de cette phase, la première dose de nivolumab doit être administrée 3 semaines après la dernière dose, en association, d'ipilimumab et nivolumab.
Tableau II - Doses recommandées et temps de perfusion pour l'administration par voie IV d'ipilimumab en association au nivolumab dans le cancer colorectal dMMR ou MSI-H
| Phase en association, toutes les 3 semaines pour 4 cycles d'administration |
Phase de monothérapie |
|
| Nivolumab (OPDIVO) | 3 mg/kg pendant 30 minutes | 240 mg toutes les 2 semaines pendant 30 minutes |
| Ipilimumab (YERVOY) | 1 mg/kg pendant 30 minutes | - |
Pour aller plus loin
Arrêté du 30 novembre 2021 modifiant la liste des spécialités pharmaceutiques agréées à l'usage des collectivités et divers services publics (Journal officiel du 3 décembre 2021 - texte 29)
Avis de la Commission de la Transparence - OPDIVO/YERVOY cancer colorectal (HAS, 3 novembre 2021)
Pour aller plus loin
Consultez les monographies VIDAL
Pour recevoir gratuitement toute l’actualité par mail Je m'abonne !

 5 minutes
5 minutes Ajouter un commentaire
Ajouter un commentaire





Commentaires
Cliquez ici pour revenir à l'accueil.