
TRUVADA est désormais remboursable dans la PrEP au VIH-1 chez l'adolescent de 15 ans et plus (illustration).
L'antirétroviral TRUVADA 200 mg/245 mg comprimé pelliculé (emtricitabine et ténofovir) bénéficie d'une extension de prise en charge dans le cadre de la PrEP (prophylaxie pré-exposition) du VIH-1, associée à des pratiques sexuelles à moindre risque. TRUVADA est désormais remboursable chez les adolescents à haut risque de contamination âgés de 15 et plus.
Jusqu'à présent, seule la population adulte bénéficiait d'une prise en charge en PrEP.
Un remboursement en décalage avec l'indication de TRUVADA
Malgré cette extension de remboursement chez les adolescents, le périmètre de prise en charge dans la PrEP n'est pas aligné sur l'autorisation de mise sur le marché (AMM) de TRUVADA (Cf. Encadré 1).
Encadré 1 - Indications thérapeutiques de TRUVADA validées par l'AMM
TRUVADA est également indiqué pour le traitement des adolescents infectés par le VIH-1, présentant une résistance ou des toxicités aux INTI empêchant l'utilisation des agents de première intention (Cf. VIDAL Reco "Infection par le VIH").
Dans ces deux indications, l'AMM prévoit une utilisation de TRUVADA chez les adultes, et les adolescents de 12 ans et plus, pesant au moins 35 kg. |
En effet, depuis février 2018, l'AMM de TRUVADA autorise son utilisation en PrEP chez les adolescents de 12 ans et plus, pesant au moins 35 kg, à haut risque de contamination.
Mais à ce jour, TRUVADA reste non remboursable en PrEP chez les adolescents de 12 à 14 ans.
Pas de données chez les 12-15 ans
TRUVADA est le seul médicament autorisé dans la PrEP pour réduire le risque d'infection par le VIH-1, par voie sexuelle.
En mars 2017, la Commission de la Transparence avait rendu un avis favorable au remboursement de TRUVADA dans la PrEP, en complément d'une stratégie globale de prévention, chez l'adulte à haut risque de contamination (Cf. Avis du 22 mars 2017).
Dans son avis du 21 novembre 2018, la Commission a évalué l'intérêt de cette stratégie de prévention chez l'adolescent, sur la base de deux études cliniques américaines, qui ont évalué la PrEP chez des jeunes adultes âgés de 18 à 22 ans (étude ATN 1109 ) et des adolescents âgés de 15 à 17 ans (étude ATN 11310) [Cf. Tableau I].
Tableau I - Etudes ATN 110 et ATN 113 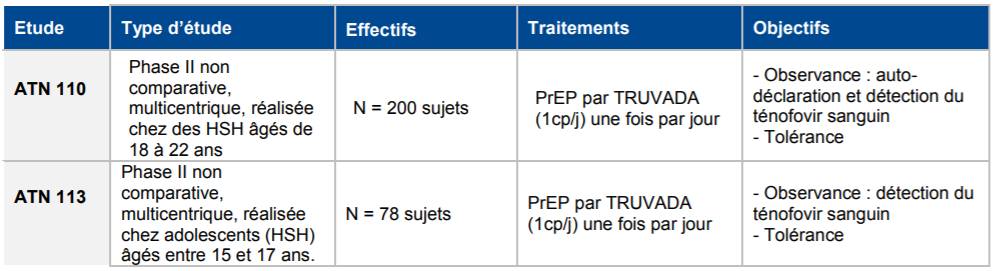

Aucune étude clinique d'efficacité n'ayant été réalisée avec TRUVADA dans la PrEP chez les adolescents de 12 à 18 ans, les données cliniques de l'étude ATN 113 réalisée chez les adolescents de 15 à 17 ans ont été prises compte pour apprécier le niveau d'observance dans cette population.
Une baisse marquée de l'observance chez les 15-17 ans
Selon les résultats de ces études, une baisse marquée de l'observance a été observée au fil du temps, reflétant les difficultés d'observance connues chez les adolescents et plus fréquentes que chez les adultes.
En effet, parmi les 78 sujets inclus dans l'étude ATN 113 (15-17 ans), 67 (86 %) ont débuté la PrEP avec TRUVADA et 39 (58 %) ont été suivi pendant 48 semaines. Le dosage de ténofovir dans le sang a montré une diminution de l'observance au cours du temps : seuls 52 % des 39 sujets suivis avaient des taux de ténofovir détectables à la semaine 48 et moins d'un tiers (22 %) avaient des concentrations sériques en ténofovir considérées comme protectrices (> 700 fmol/punch) [Cf. Tableau II].
Les raisons de ce manque d'observance le plus souvent évoquées ont été : l'éloignement du domicile (32 %), l'occupation à d'autres choses (28 %), l'oubli de la prise du comprimé (26 %) et des changements d'habitude (18 %).
La PrEP moins efficace chez les adolescents, en lien avec les difficultés d'observance
Concernant le suivi de séroconversion, trois sujets inclus ont été infectés par le VIH au cours des 48 semaines de suivi, soit un taux d'incidence de 6,4 pour 100 personnes-années (IC 95 % = [1,3 - 18,7]).
La Commission de la Transparence indique que "les concentrations de ténofovir des sujets infectés étaient incompatibles avec une observance supérieure ou égale à 2 prises par semaine".
En effet, chez les adolescents de 15 à 17 ans, l'incidence rapportée de séroconversion dans l'étude ATN 113 est deux fois plus élevée que celle rapportée chez les adultes (étude iPrEX, N Engl J Med 2010) et les jeunes adultes (étude ATN 110) : selon la Commission, ces constats suggèrent que la PrEP serait moins efficace chez les adolescents en raison des difficultés d'observance (Cf. Tableau II).
Tableau II - Exposition au ténofovir au cours du suivi dans l'étude ATN 113
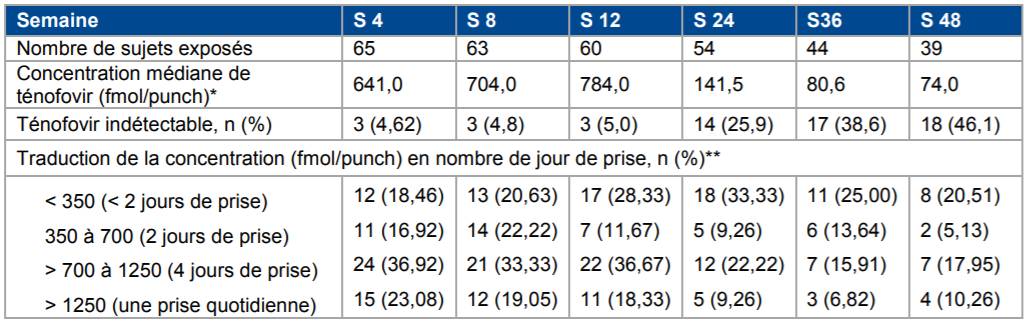
* Concentrations de ténofovir mesurées sur les échantillons de sang sec
** Concentration en ténofovir traduite en nombre de jours de prise par semaine
Attention à la toxicité rénale et osseuse
La Commission conclut son avis sans pouvoir se prononcer sur l'observance, l'efficacité et la tolérance chez les adolescents de 12 à 15 ans et les adolescentes de 12 à 18 ans, faute de données dans ces populations.
Elle souligne qu'il n'existe "aucune donnée sur les effets à long terme sur la fonction rénale et sur les effets osseux de TRUVADA lorsqu'il est utilisé dans cette indication chez les adolescents".
Pour la HAS, TRUVADA en PrEP chez les adolescents apporte une réponse théorique, en complément des autres moyens de prévention comme le préservatif. La Commission de la Transparence rappelle par ailleurs que TRUVADA ne protège pas contre les autres IST (infections sexuellement transmissibles).
Chez l'adolescent, la Commission a donc recommandé que le remboursement de la PrEP par TRUVADA soit restreint aux sujets âgés de 15 ans et plus, à haut risque d'infection par le VIH n'ayant ni pathologie rénale, ni pathologie osseuse, et à un stade de développement pubertaire de Tanner de 4/5.
SMR important, sans ASMR, chez l'adolescents de 15 ans et plus
La Commission de la Transparence considère que TRUVADA apporte un service médical rendu (SMR) important, exclusivement chez les adolescents à haut risque de contamination âgés de 15 ans et plus, et en complément d'une stratégie globale de prévention.
Tenant compte de l'efficacité démontrée chez l'adulte en termes de diminution de l'incidence de l'infection par le VIH chez des sujets à haut risque de contamination, la Commission estime que, comme chez l'adulte, TRUVADA n'apporte pas d'amélioration du service médical rendu (ASMR V) chez les adolescents à haut risque de contamination âgés de 15 ans et plus, dans la stratégie globale de prévention du VIH dont l'outil central doit rester le préservatif.
A l'appui de cet avis, la Commission a pris en compte le fait que TRUVADA assure une protection partielle contre le VIH fortement dépendante de l'observance et sans effet préventif sur les autres infections sexuellement transmissibles (IST).
La Commission a également considéré les difficultés d'observance chez l'adolescent, plus fréquentes que chez l'adulte, et la toxicité, notamment rénale et osseuse, particulièrement préoccupante dans cette population en croissance.
TRUVADA en pratique chez l'adolescent de 15 ans et plus
TRUVADA doit être initié par des médecins expérimentés dans la prise en charge de l'infection par le VIH. Sa prescription initiale est hospitalière ou en CeGIDD. Elle est valable un an, son renouvellement n'est pas restreint.
- Schéma en continu
La PrEP en discontinu ne peut pas être recommandée à d'autres populations exposées que les HSH (adultes et adolescents).
- Un comprimé par jour, une fois par jour
Il est préférable que TRUVADA soit pris avec de la nourriture. Le comprimé pelliculé peut être délité dans environ 100 ml d'eau, de jus d'orange ou de jus de raisin et administré immédiatement après.
- Un suivi rapproché
Le ténofovir étant principalement éliminé par le rein à la fois par filtration glomérulaire et sécrétion tubulaire active, le suivi portera également sur la fonction rénale (clairance de la créatinine et phosphate sérique) qui devra être évaluée avant l'initiation de TRUVADA et surveillée pendant l'utilisation, comme chez les adultes :
- après deux à quatre semaines d'utilisation, après trois mois d'utilisation et tous les trois à six mois par la suite,
- chez les sujets présentant un risque d'insuffisance rénale, une surveillance plus fréquente de la fonction rénale est nécessaire.
L'utilisation de ténofovir disoproxil peut provoquer une diminution de la DMO (densité minérale osseuse), la détection ou la suspicion d'anomalies osseuses pendant l'utilisation de TRUVADA chez tout patient pédiatrique doit imposer une consultation avec un endocrinologue et/ou un néphrologue.
- Confidentialité
Dans cette situation, en dehors de la gratuité des soins, il faut s'assurer de la confidentialité administrative de la prise en charge.
Pour aller plus loin
Arrêté du 27 février 2019 - Extension du remboursement de TRUVADA (Journal officiel du 19 février 2019, texte 10)
Avis de la Commission de la Transparence - TRUVADA / PrEP (HAS, 21 novembre 2018)
Pour aller plus loin
Consultez les VIDAL Recos
Pour recevoir gratuitement toute l’actualité par mail Je m'abonne !

 7 minutes
7 minutes Ajouter un commentaire
Ajouter un commentaire






Commentaires
Cliquez ici pour revenir à l'accueil.