L'exposition des foetus au valproate de sodium pendant otut ou partie de la grossesse est associée à une augmentation du risque de malformations et de troubles du développement (illustration).
Réalisation d'une étude observationnelle à partir des données de l'Assurance Maladie sur toutes les femmes françaises
Le Pôle Epidémiologie des produits de santé (Direction scientifique et de la stratégie européenne) de l'Agence nationale de sécurité du médicament et des produits de santé (ANSM) et le Département d'études en santé publique de la Caisse nationale de l'assurance maladie ont procédé à une étude de cohorte rétrospective afin d'évaluer le degré d'exposition des femmes enceintes au valproate de sodium (DEPAKINE et dérivés), ainsi que son évolution au cours du temps, les modalités de la prescription, le devenir de la grossesse, etc.
Cette étude, dont le rapport a été publié le 24 août 2016, ainsi qu'une synthèse, a été réalisée à partir des données du SNIIRAM (système national interrégimes de l'assurance maladie) sur les femmes ayant débuté une grossesse en France entre le 1er janvier 2007 et le 31 décembre 2014, en particulier les données de consommation interrégimes (DCIR) chaînées aux données d‘hospitalisations du Programme de médicalisation des systèmes d'information (PMSI).
14 322 grossesses sous valproate de sodium entre 2007 et 2014
Les résultats montrent qu'1,9 grossesse sur 1 000 s'est déroulée au moins partiellement sous valproate de sodium, soit 14 322 grossesses entre 2007 et 2014.
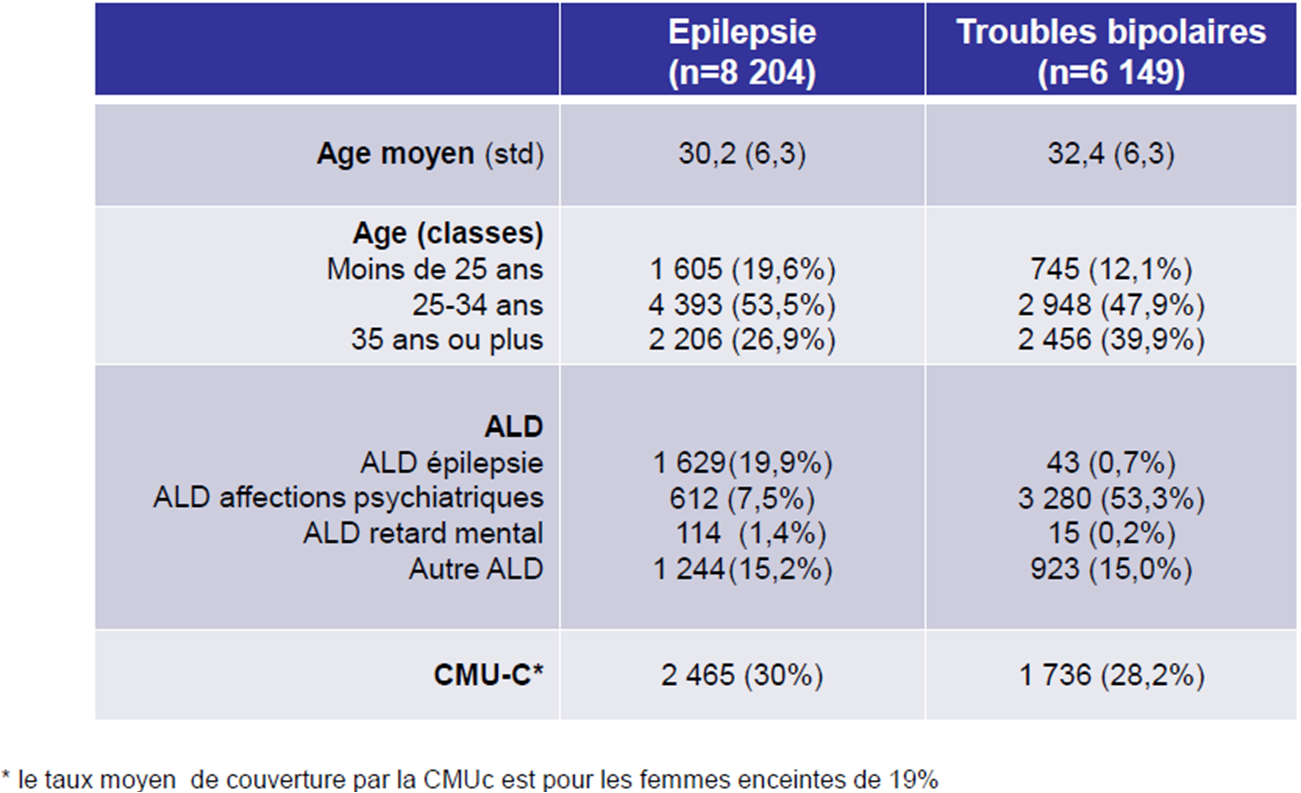
Le valproate de sodium était prescrit soit pour épilepsie (8 204 grossesses), soit pour troubles bipolaires (6 149 grossesses) :
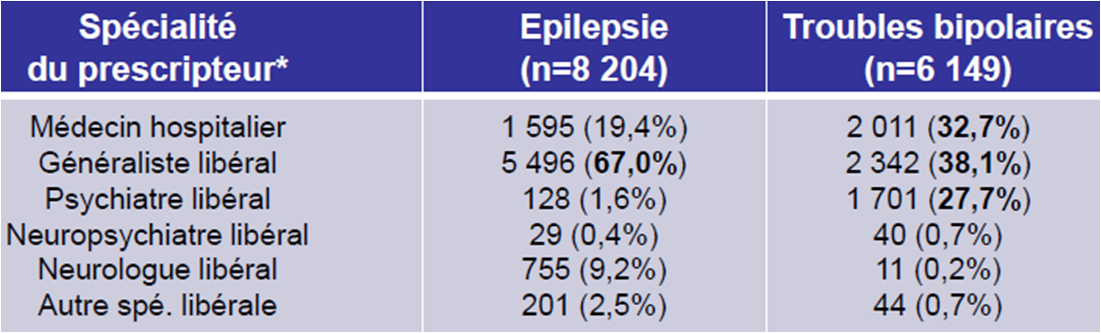
Une majorité des prescriptions effectuées par des médecins libéraux, mais la prescription initiale est souvent hospitalière
Les deux tiers des prescriptions de valproate de sodium à des femmes enceintes épileptiques ont été effectuées par des médecins généralistes libéraux. Rappelons cependant que la plupart du temps, la prescription initiale est hospitalière, les médecins généralistes appliquant ensuite cette prescription et ses renouvellements.
En ce qui concerne les patientes atteintes d'une maladie bipolaire et enceintes, les généralistes et psychiatres libéraux ont réalisé 65,8 % des prescriptions de valproate de sodium :
Seules 56 % de ces grossesses ont été à leur terme, soit 8 701 enfants exposés in utero entre 2007 et 2014
Sur ces 14 322 grossesses, 8 701 enfants sont nés vivants, et ont donc été exposés à l'acide valproïque in utero :
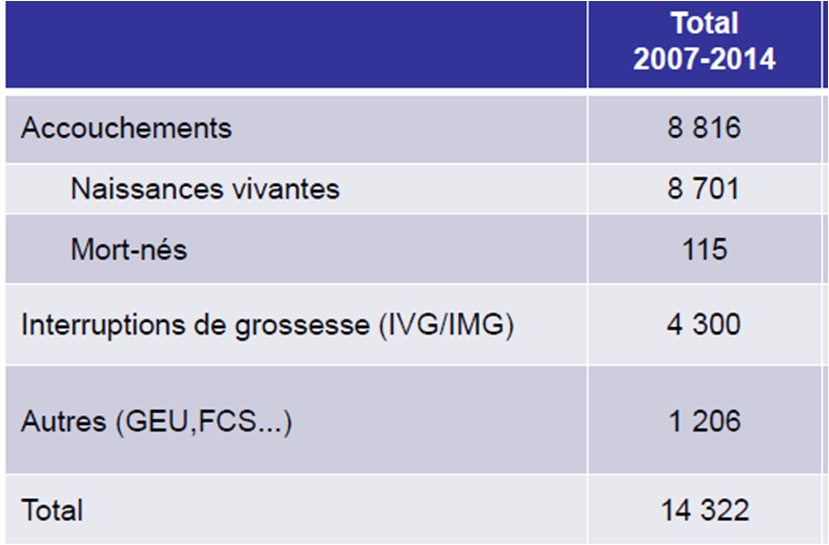
Les motifs des interruptions de grossesses, volontaires (IVG) ou non (IMG), ne sont pas précisés dans cette étude.
Etant donné que ce médicament est commercialisé depuis 1967, probablement plus de 50 000 enfants ont été exposés au valproate de sodium pendant la grossesse de leur mère.
Les deux tiers de ces enfants ont été exposés pendant les 3 trimestres de la grossesse lorsque leur mère était atteinte d'épilepsie, beaucoup plus rarement en cas de maladie bipolaire
L'exposition au valproate de sodium de ces 8 701 enfants s'est effectuée au cours du 1er trimestre pour 88 % des nouveaux-nés. Cette exposition a été maintenue aux 2e et 3e trimestres pour 68 % et 66 % des bébés nés de mère atteinte d'épilepsie, et pour 15 et 14 % des bébés nés de mère atteinte d'une maladie bipolaire.
En conséquence, la durée d'exposition était plus élevée en cas d'épilepsie : 117 jours en moyenne, contre 44 en cas de maladie bipolaire.
Cette durée d'exposition a baissé de 26 % entre 2007 et 2014 en cas d'épilepsie, et de 7 % en cas de troubles bipolaires.
Pas d'information dans cette étude sur le pourcentage d'enfants atteints, mais l'IGAS a fait une estimation début 2016 et les risques ont déjà été évalués
Le nombre d'enfants vivants ou mort-nés exposés in utero au valproate entre 2006 et 2014 et porteurs d'une malformation congénitale a été estimé entre 425 et 450 cas par l'IGAS, en extrapolant à partir de données régionales (voir notre article de février 2016).
Pour Marine Martin, présidente de l'association APESAC (Association d'Aide aux Parents d'Enfants souffrant du Syndrome de l'Anti-Convulsivant), ce chiffre est probablement largement sous-estimé : l'IGAS se base sur les premières données de pharmacovigilance mais il faudrait également tenir compte des nombreux cas qui ne sont pas notifiés et qui échappent aujourd'hui aux données de pharmacovigilance.
La médiatisation de ces risques et les expertises consécutives permettront peut-être d'en savoir plus sur le nombre d'enfants atteints de malformations et/ou troubles du développement, qui devrait se compter en milliers, au moins : l'exposition au valproate de sodium pendant la grossesse est en effet associée à une multiplication par 3 à 4 des risques de malformations faciales (fentes palatines) ou neurales (anomalie du tube neural), et à une fréquence plus élevée de troubles du développement et/ou neuro-psychiatriques (retard de la marche et de la parole, troubles de la mémoire, de l'expression et du langage, diminution des capacités intellectuelles, troubles autistiques, etc. voir notre article décembre 2014).
Entre 2007 et 2014, une baisse de plus de 40 % du nombre annuel de grossesses et accouchements sous valproate de sodium
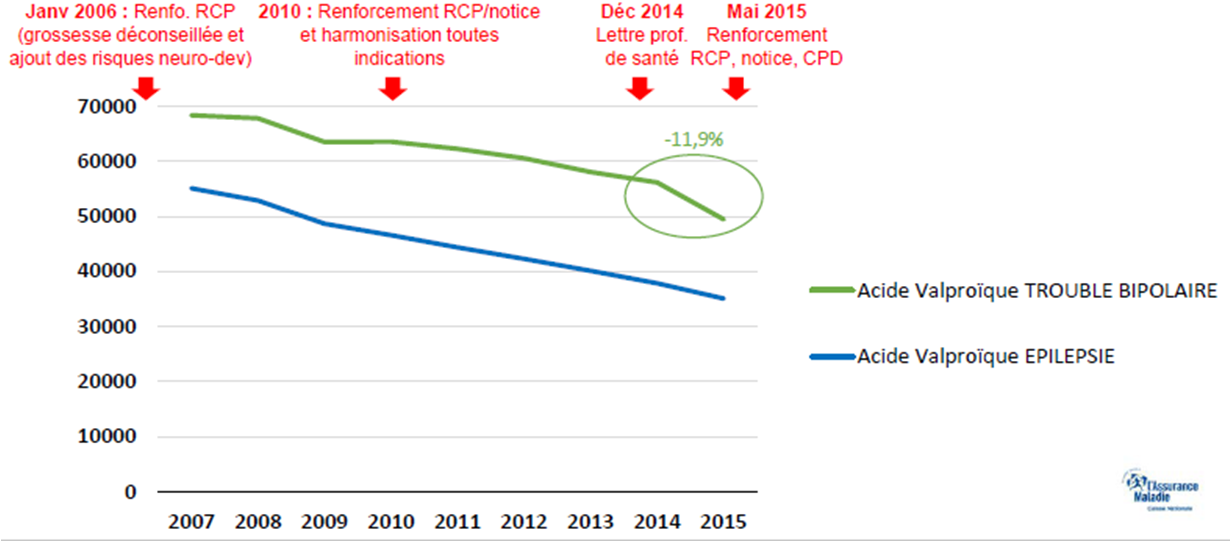
Le nombre annuel de grossesses sous valproate de sodium et dérivés a diminué de 42,4 % entre 2007 et 2014. Cette diminution a été beaucoup plus forte lorsque le valproate était prescrit pour épilepsie (- 55,9 %) que lorsqu'il était prescrit pour troubles bipolaires (- 18 %) :
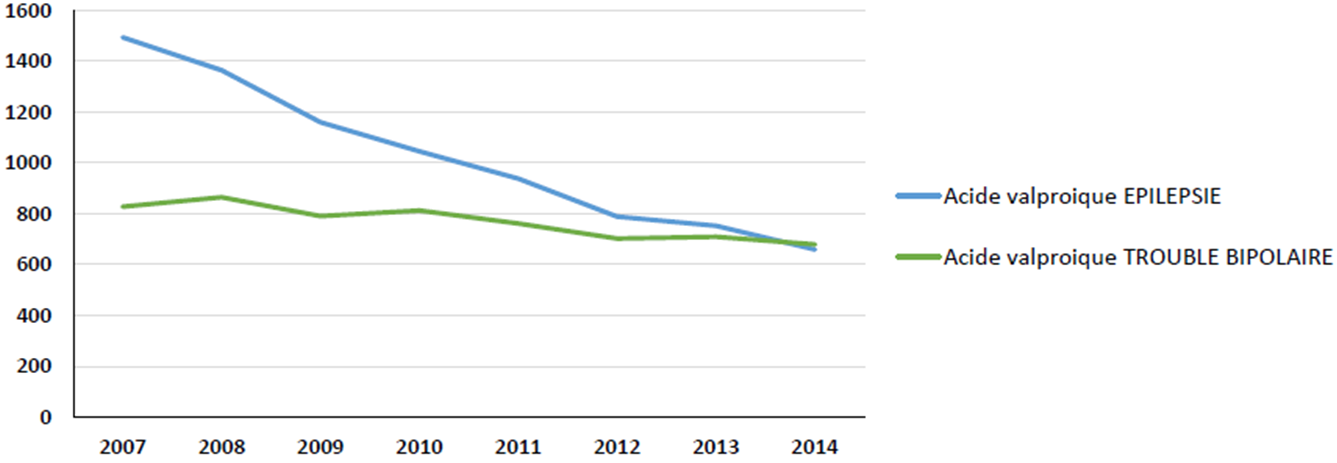
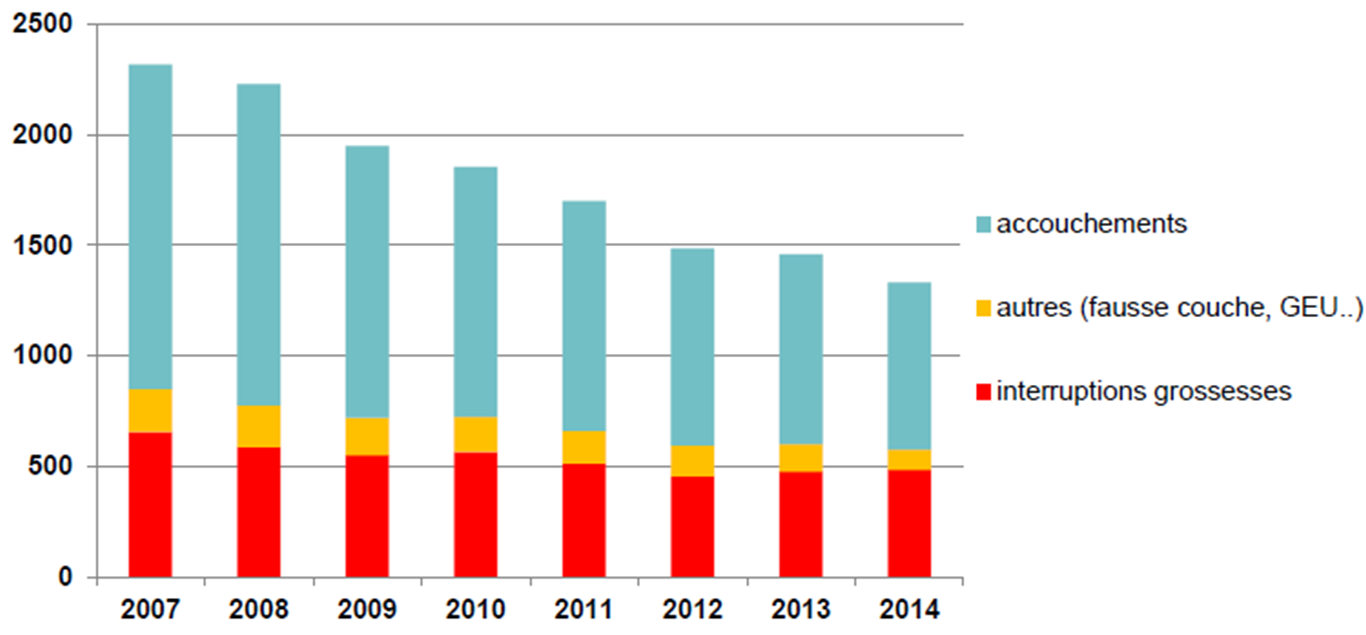
Les accouchements sous valproate ont également fortement diminué, de 48 %, entre 2007 et 2014. Cette diminution concerne surtout les femmes épileptiques enceintes (baisse de 60 %), alors que la diminution constatée chez les femmes atteintes d'une maladie bipolaire n'est que de 18 %. Les interruptions de grossesses, volontaires (IVG) ou médicales (IMG), ont également diminué, mais moins nettement (- 26 %) :
Epilepsie, maladie bipolaire et grossesse : constat d'un report des prescriptions
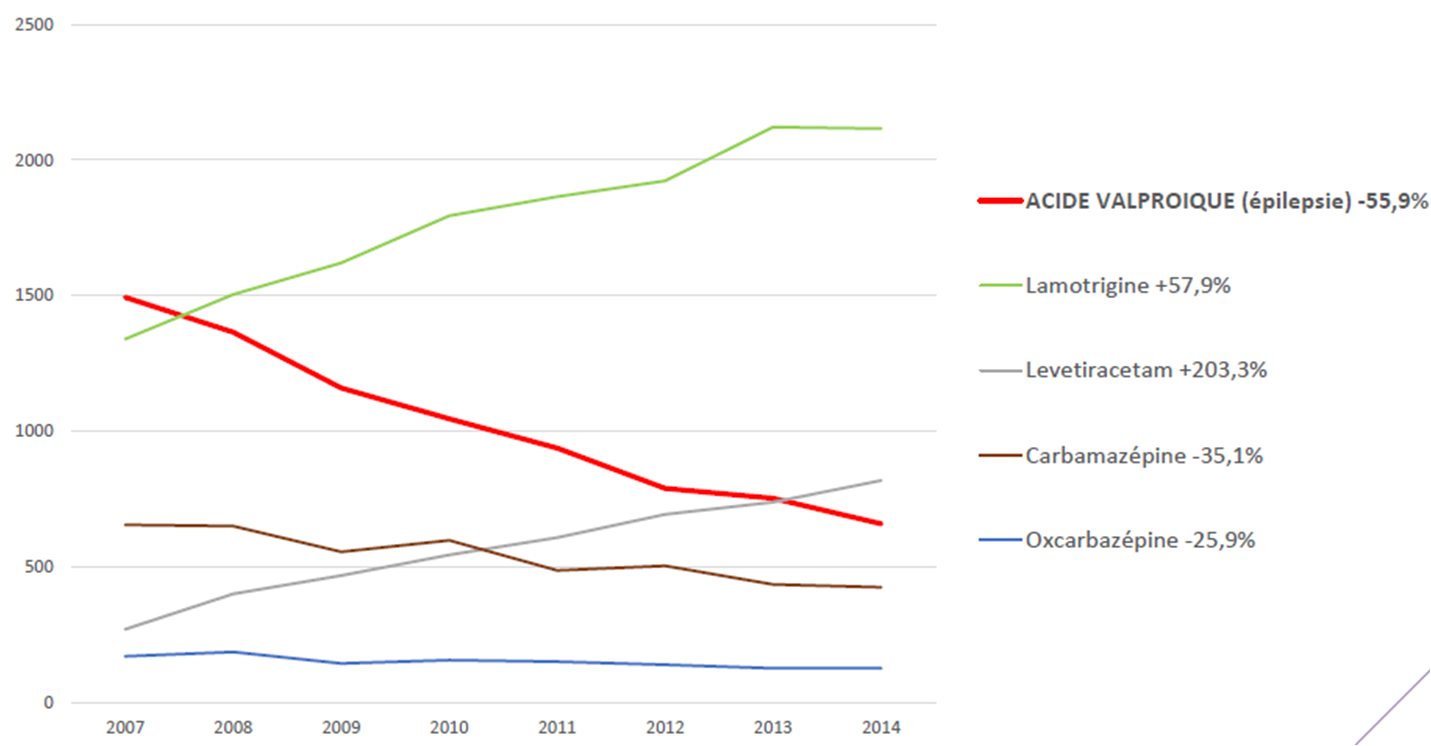
L'analyse du nombre de grossesses chez des femmes traitées pour épilepsie montre un report des prescriptions vers lamotrigine et lévétiracétam, deux médicaments qui semblent comporter peu ou pas de risques malformatifs, selon leurs mentions légales (voir aussi VIDAL Reco Epilepsie : arbre décisionnel, pour les alternatives thérapeutiques actuellement disponibles) :
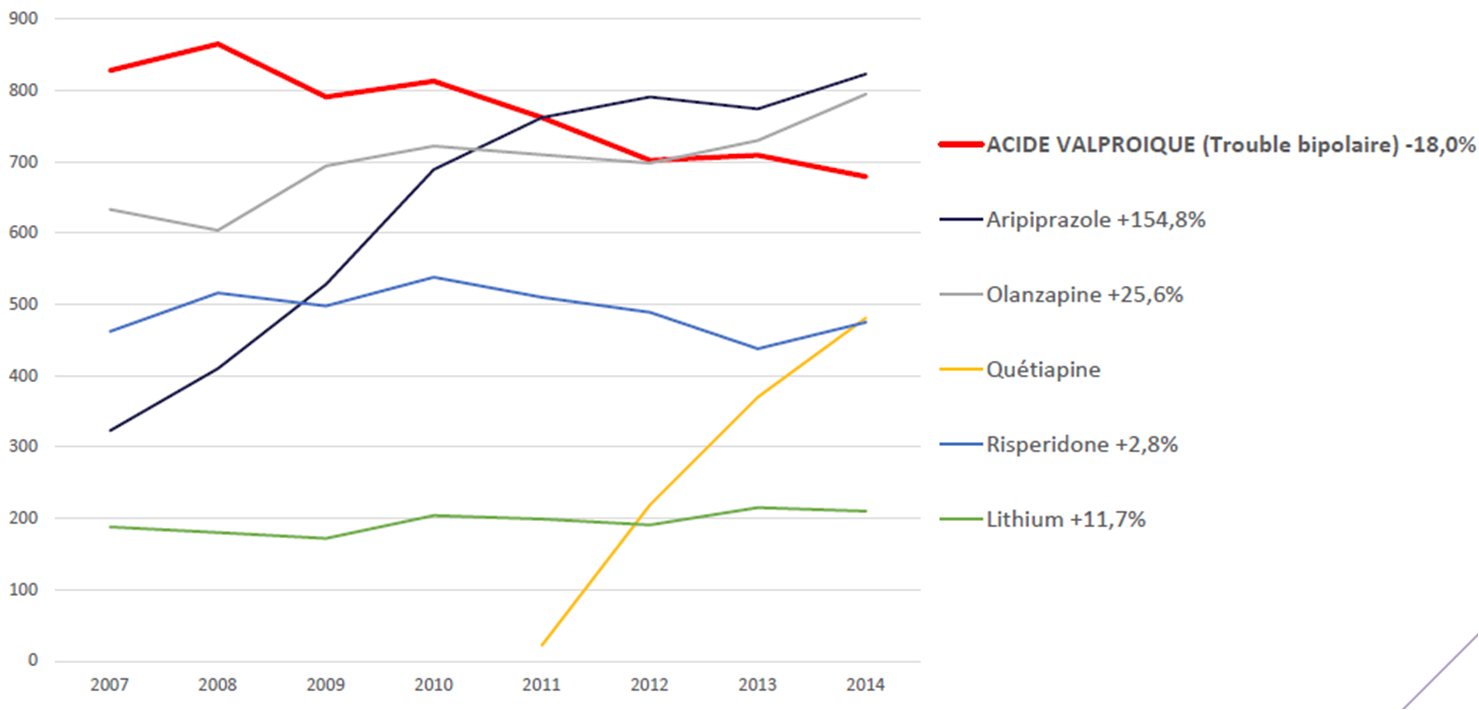
En cas de maladie bipolaire et grossesse, un report des prescriptions vers des antipsychotiques atypiques (aripiprazole, olanzapine) est relevé (voir aussi VIDAL Reco Trouble bipolaire : arbre décisionnel, pour les alternatives thérapeutiques actuellement disponibles) :
Ces reports sont probablement liés à la sensibilisation grandissante des professionnels de santé sur les risques tératogènes du valproate de sodium, avec en particulier l'ajout dans les mentions légales de ces médicaments (RCP) de la mention "l'utilisation du valproate est déconseillée tout au long de la grossesse et chez la femme en âge de procréer sans contraception efficace" en 2006.
Baisse des prescriptions chez les femmes "en âge de procréer", mais plus de 50 000 prennent encore du valproate de sodium
Le nombre de femmes prenant de l'acide valproïque alors qu'elles sont susceptibles d'avoir un enfant (« en âge de procréer") a diminué de 32 % entre 2007 (122 382 femmes) et 2015 (83 712 femmes), traduisant également l'impact de la sensibilisation aux risques tératogènes :
Il reste cependant 51 512 femmes en âge de procréer sous valproate de sodium. Rappelons que dans certains cas, certaines femmes ne peuvent recevoir aucun autre traitement.
Les auteurs estiment donc qu'il est nécessaire de renforcer les mesures de réduction du risque, de poursuivre le suivi du niveau d'exposition et d'étendre le suivi aux autres traitements de l'épilepsie et des troubles bipolaires.
Renforcement du plan d'action annoncé par Marisol Touraine, avec notamment un dispositif d'indemnisaiton pour les victimes, un pictogramme sur les boîtes et des alertes dans les logiciels d'aide à la prescription
Au vu de ces résultats, Marisol Touraine annonce un renforcement du plan d'action de mars 2016 (voir la fin de cet article), avec :
- "la mise en place effective dans les six mois du protocole national de dépistage et de signalement (PNDS) en cours d'élaboration, qui permettra une prise en charge en totalité par l'Assurance maladie des soins des patients identifiés dans le cadre ce programme ;
- sur la base des travaux issus de la mission d'expertise juridique lancée au mois de mars, la mise en place d'un dispositif d'indemnisation pour les victimes, qui sera voté au Parlement d'ici la fin de l'année dans le cadre des lois financières. La mission d'expertise juridique sera amenée à rencontrer prochainement le laboratoire Sanofi ;
- le renforcement de l'information liée à la prise de médicaments contenant de
 l'acide valproïque au cours de la grossesse : un pictogramme indiquant le danger de son utilisation pendant la grossesse (cf. ci-contre), conçu en lien étroit avec l'association APESAC, sera apposé sur les boîtes de médicaments en plus des mentions d'alerte déjà existantes dans les 6 mois (compte tenu des délais de fabrication des boîtes) ;
l'acide valproïque au cours de la grossesse : un pictogramme indiquant le danger de son utilisation pendant la grossesse (cf. ci-contre), conçu en lien étroit avec l'association APESAC, sera apposé sur les boîtes de médicaments en plus des mentions d'alerte déjà existantes dans les 6 mois (compte tenu des délais de fabrication des boîtes) ; - la création d'un système d'alerte dans les logiciels d'aide à la prescription et à la dispensation utilisés par les médecins et les pharmaciens ;
- l'élargissement des mesures de précaution aux autres traitements de l'épilepsie et des troubles bipolaires : l'ANSM réévaluera ainsi 21 substances actives pour le traitement de l'épilepsie. Cette réévaluation sera également mise en place pour les traitements des troubles bipolaires, pour lesquels l'utilisation d'acide valproïque sera rendue plus contraignante. Un suivi prospectif de l'ensemble des antiépileptiques sera réalisé en lien avec l'APESAC ;
- par ailleurs, la proposition de registre national des malformations congénitales, créé à partir de la fédération des six registres existants, sera présentée lors de la prochaine réunion du Comité stratégique des registres, le 4 octobre prochain. Le cahier des charges finalisé est prévu pour novembre prochain ;
- le renforcement des mesures de réduction du risque pour l'acide valproïque, avec la poursuite de la communication vers les professionnels de santé, l'information des patientes et des études en cours".
En conclusion : une exposition importante mais en baisse depuis 2007, une promesse d'indemnisation des victimes, un renforcement des précautions et une persistance d'inconnues
L'étude observationnelle effectuée par l'ANSM et l'Assurance maladie montre que près de 9 000 enfants ont été exposés entre 2007 et 2014, ce qui laisse supposer que des dizaines de milliers d'enfants ont été exposés depuis la fin des années 60. Par contre, le pourcentage d'effets tératogènes n'a pas été évalué par cette étude. L'indemnisation promise par Marisol Touraine et demandée depuis des mois par les familles de victimes (association APESAC) sera de toute façon étudiée au cas par cas.
Cette étude permet de constater aussi que cette exposition a baissé, probablement en raison des informations croissantes sur les risques tératogènes avérés de ce médicament, mais aussi en raison de l'utilisation d'autres médicaments permettant une alternative thérapeutique et d'une possible diminution de l'utilisation hors AMM. La prescription a donc probablement été affinée et remplacée par une autre lorsque c'était possible dans de nombreux cas. De même, les conditions de la décision d'une grossesse et, le cas échéant, de son arrêt éventuel ont été probablement améliorées par l'information progressivement croissante des femmes concernées sur ces risques.
Certes, plus de 50 000 femmes en âge de procréer prennent encore du valproate de sodium en France, ce qui peut faire craindre de nouveaux risques pour leurs éventuels enfants, d'où le renforcement nécessaire des mesures de précaution et d'information. Mais est-il possible de faire autrement pour contrôler leur pathologie ? Il est impossible de dire, sur ces données, si le valproate est la seule solution préventive possible chez ces 50 000 femmes.
Or si ce médicament est la seule solution préventive pour certaines, il doit a priori être maintenu sous peine de complications parfois gravissimes, et les risques en cas de grossesse doivent donc être bien expliqués et soupesés avec ceux encourus en l'absence de traitement (risques pour la mère et l'enfant).
Rappelons aussi que les autres médicaments de l'épilepsie peuvent aussi entraîner des effets secondaires pour le fœtus, d'où des suivis enclenchés et de la transmission des informations, aux médecins et aux femmes concernées qui souhaiteraient avoir un enfant.
Il s'agit donc d'une problématique complexe, comme souvent en médecine... Cette complexité est liée à la situation particulière de ces médicaments efficaces mais à risque tératogène, ainsi qu'aux conséquences cumulées des déficits d'information, en particulier des femmes susceptibles d'être ou de s'apprêter à être enceintes (de plus, il n'est pas toujours facile pour elles de parler de ces deux pathologies), et de formation probablement insuffisante des professionnels pendant plusieurs décennies. La médiatisation actuelle ainsi que le pictogramme sur les boîtes auront au moins l'avantage d'inciter les femmes sous valproate à parler davantage de leur grossesse, voire de leur désir d'enfant, à leur médecin.
Rappel : les médicaments concernés
Les médicaments contenant du valproate de sodium et dérivés commercialisés en France sont les suivants :
- DEPAKINE formes orales et forme injectable (valproate de sodium) et génériques,
- DEPAKINE CHRONO et génériques,
- DEPAKOTE (divalproate de sodium),
- DEPAMIDE (valpromide),
- MICROPAKINE (valproate de sodium).
DEPAKINE et MICROPAKINE sont indiqués dans le traitement de l'épilepsie (voir VIDAL Reco Epilepsie de l'adulte et Epilepsie de l'enfant). Chez l'enfant, ils disposent d'une indication en prévention de la récidive de crises après une ou plusieurs convulsions fébriles (Cf. VIDAL Reco Convulsions fébriles), présentant les critères de convulsions fébriles compliquées, en absence d'efficacité d'une prophylaxie intermittente par benzodiazépines.
DEPAKOTE et DEPAMIDE sont indiqués en deuxième intention dans les épisodes maniaques du trouble bipolaire (Cf. VIDAL Reco Troubles bipolaires).
En savoir plus :
- Spécialités pharmaceutiques comprenant de l'acide valproïque (Dépakine® et dérivés) : Marisol TOURAINE annonce la mise en place d'un dispositif d'indemnisation pour les familles, communiqué du ministère de la santé, 24 août 2016
- Exposition à l'acide valproïque et ses dérivés au cours de la grossesse en France de 2007 à 2014 : une étude observationnelle sur les données du SNIIRAM, rapport ANSM - Assurance Maladie, 24 août 2016
- Exposition à l'acide valproïque et ses dérivés au cours de la grossesse en France de 2007 à 2014 : une étude observationnelle sur les données du SNIIRAM - synthèse du rapport, 24 août 2016
- Exposition à l'acide valproïque et ses dérivés au cours de la grossesse en France de 2007 à 2014 Résultats de l'étude observationnelle sur les données du SNIIRAM, diaporama (dont sont issus les tableaux et graphes repris dans cet article), 24 août 2016
Sur VIDAL.fr :
- VIDAL Reco "Epilepsie de l'adulte"
- VIDAL Reco "Epilepsie de l'enfant"
- Valproate de sodium et risque tératogène : analyses et recommandations de l'IGAS, réponses de l'ANSM et de la DGS (février 2016)
- Valproate de sodium et risque tératogène : quelles sont les alternatives thérapeutiques ? (10 décembre 2015)
- Epilepsie, traitée ou non, et grossesse : analyse des éventuels surrisques d'évènements indésirables (3 décembre 2015)
- Médicaments à base de valproate et dérivés : renforcement des conditions de prescription et de délivrance (27 mai 2015)
- Médicaments contenant du valproate de sodium et dérivés : renforcement des restrictions d'indication (11 décembre 2014)
Pour aller plus loin
Consultez les monographies VIDAL
- DEPAKINE 200 mg cp gastrorésis
- DEPAKINE 200 mg/ml sol buv
- DEPAKINE 400 mg/4 ml prép inj IV
- DEPAKINE 500 mg cp gastrorésis
- DEPAKINE 57,64 mg/ml sirop
- DEPAKINE CHRONO 500 mg cp pellic séc LP
- DEPAKOTE 250 mg cp gastrorésis
- DEPAKOTE 500 mg cp gastrorésis
- DEPAMIDE 300 mg cp pellic gastrorésis
- MICROPAKINE LP 100 mg glé LP
- MICROPAKINE LP 1000 mg glé LP
- MICROPAKINE LP 250 mg glé LP en sachet-dose
- MICROPAKINE LP 500 mg glé LP
- MICROPAKINE LP 750 mg glé LP
Consultez les VIDAL Recos
Sources
Pour recevoir gratuitement toute l’actualité par mail Je m'abonne !

 10 minutes
10 minutes 4 commentaires
4 commentaires .jpg)





Commentaires
Cliquez ici pour revenir à l'accueil.