Les arthrites de la maladie de Still sont disséminées (polyarthrite) et touchent les grosses articulations mais aussi les articulations des doigts et le rachis cervical (illustration).
ILARIS, anticorps monoclonal à base de canakinumab, est désormais remboursé en ville et agréé aux collectivités dans le traitement de la maladie de Still de l'adulte (MSA) en seconde intention (réponse inadéquate à un précédent traitement par anti-inflammatoire non stéroïdien et par corticoïdes systémiques).
Dans cette indication, la Commission de la Transparence (CT) a attribué à ILARIS un service médical rendu (SMR) important, assorti d'un ensemble de recommandations pour encadrer son utilisation (avis du 18 novembre 2020).
Les prescripteurs peuvent s'appuyer sur le protocole national de diagnostic et de soin (PNDS) consacré à cette maladie pour utiliser le canakinumab dans le traitement de la MSA.
Comme dans les autres indications, la prise en charge d'ILARIS est conditionnée par une prescription de médicament d'exception, conforme à la fiche d'information thérapeutique en vigueur.
Cette extension de prise en charge concerne le remboursement en ville et l'agrément aux collectivités, et s'applique aux deux spécialités de la gamme ILARIS :
- ILARIS 150 mg poudre pour solution injectable en flacon,
- ILARIS 150 mg solution injectable en flacon.
Encadré 1 - Indications thérapeutiques d'ILARIS
Syndromes de fièvres périodiques :
ILARIS est indiqué dans le traitement des syndromes périodiques associés à la cryopyrine (CAPS), incluant :
|
Pour mémoire, ILARIS est remboursable au taux 65 % selon la procédure des médicaments d'exception (cf. Fiche d'information thérapeutique - Journal officiel du 25 juin 2021 - texte 27).
ILARIS est un médicament soumis à prescription hospitalière ; sa prescription initiale et son renouvellement sont par ailleurs réservés aux spécialistes en rhumatologie, en médecine interne, en dermatologie ou en pédiatrie.
Le canakinumab dans la maladie de Still
ILARIS a obtenu l'indication dans le traitement de la MSA (cf. Encadré 2) en août 2016.
Dans son avis du 18 novembre 2020, la Commission de la Transparence (CT) évaluait la population ciblée par cette indication à environ 200 patients en France.
Encadré 2 - La maladie de Still de l'adulte (source HAS)
| La maladie de Still de l'adulte (MSA) est un syndrome auto-inflammatoire systémique rare, de cause inconnue, sans caractère familial. Ce syndrome est défini cliniquement chez un patient dont la maladie commence après l'âge de 16 ans, en l'absence d'une autre maladie générale ou systémique (absence de facteur rhumatoïde ou d'anticorps antinucléaires, d'une hémopathie ou d'un cancer), par une constellation évocatrice de quatre signes cardinaux :
|
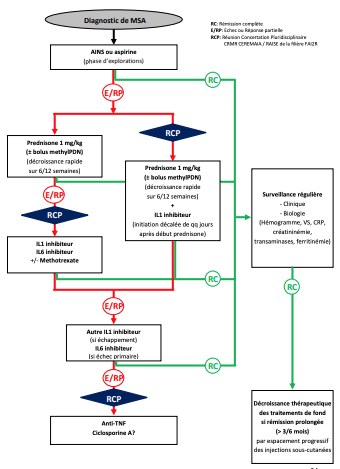
La place du canakinumab dans la stratégie de prise en charge de la MSA et les recommandations d'utilisation (dose) ont été précisées dans un Protocole national de diagnostic et de soin (PNDS) publié en août 2018 par la Haute Autorité de Santé (cf. Figure 1) :
- traitement de 2e intention à utiliser chez les patients ayant eu une réponse inadéquate à un précédent traitement par AINS et corticoïdes systémiques ;
- dose recommandée de 150 mg/mois (parfois 300 mg) par voie sous-cutanée.
(source PNDS - Maladie de Still de l'adulte - 2017)
Évaluation médico-économique du canakinumab dans la MSA
La CT a examiné en 2020 l'inscription d'ILARIS dans cette nouvelle indication en vue de sa prise en charge par la collectivité. Dans son avis du 18 novembre 2020, elle attribue un service médical rendu (SMR) important à ILARIS dans la MSA, sans amélioration du service médical rendu (ASMR V).
Elle considère que la place d'ILARIS (canakinumab) dans le traitement de la MSA de l'adulte est celle d'un traitement de 2e intention, au même titre que KINERET (anakinra), à utiliser chez les patients ayant eu une réponse inadéquate à un précédent traitement par AINS et corticoïdes systémiques. La CT a tenu compte :
- de l'efficacité d'ILARIS établie chez les patients pédiatriques atteints d'arthrite juvénile idiopathique systémique et du continuum clinique avec la MSA,
- et de son usage bien établi chez les patients atteints de MSA, étayé par les recommandations d'experts et les nombreuses données observationnelles disponibles dans la littérature.
Les recommandations d'utilisation émises par la CT
À l'issue de cette évaluation, la Commission a émis des recommandations pour encadrer l'utilisation d'ILARIS dans la MSA :
- la décision de prescription d'ILARIS doit être prise en réunion de concertation pluridisciplinaire (RCP) dans les centres de références et de compétence de la filière de santé des maladies auto-immunes et auto-inflammatoires rares ;
- ILARIS (canakinumab) doit être utilisé selon la stratégie établie dans le cadre du PNDS, notamment en termes de dose recommandée (150 mg/mois par voie SC - cf. Infra) ;
- la 1re injection SC doit être réalisée dans une structure de soins adaptée, compte tenu du risque rare, mais grave, de réactions systémiques à l'injection incluant des réactions anaphylactiques avec le canakinumab (ainsi qu'avec les autres traitements de fond biologiques).
Pour aller plus loin
Arrêté du 15 juin 2021 modifiant la liste des spécialités pharmaceutiques remboursables aux assurés sociaux (Journal officiel du 25 juin 2021 - Fiche d'information thérapeutique - texte 27)
Arrêté du 15 juin 2021 modifiant la liste des spécialités pharmaceutiques agréées à l'usage des collectivités et divers services publics (Journal officiel du 25 juin 2021 - texte 28)
Avis de la Commission de la Transparence - ILARIS et maladie de Still (HAS, 18 novembre 2020)
PNDS - Guide maladie chronique - Maladie de Still (HAS, 10 août 2018)
L'étude pivot
Kedor C. et al. Canakinumab for Treatment of Adult-Onset Still's Disease to Achieve Reduction of Arthritic Manifestation (CONSIDER): phase II, randomised, double-blind, placebo-controlled, multicentre, investigator-initiated trial. Ann Rheum Dis. 2020

 5 minutes
5 minutes Ajouter un commentaire
Ajouter un commentaire





Commentaires
Cliquez ici pour revenir à l'accueil.