Représentation en 3D de vertèbres atteintes d'ostéoporose (illustration).
L'arsenal thérapeutique de l'ostéoporose s'enrichit d'un nouveau médicament à base de tériparatide, TERROSA 20 µg/80 µL solution injectable en cartouche, indiquée chez l'adulte, dans :
- le traitement de l'ostéoporose chez les patients à risque élevé de fracture : ostéoporose postménopausique et ostéoporose masculine. Chez les femmes ménopausées, une réduction significative de l'incidence des fractures vertébrales et périphériques, mais non des fractures de la hanche, a été démontrée (cf. VIDAL Reco "Ostéoporose") ;
- le traitement de l'ostéoporose cortisonique chez les femmes et les hommes à risque élevé de fracture recevant une corticothérapie au long cours par voie générale.
TERROSA a reçu une autorisation de mise sur le marché (AMM) européenne.
Il fait l'objet d'une surveillance supplémentaire qui permettra l'identification rapide de nouvelles informations relatives à la sécurité. Les professionnels de santé déclarent tout effet indésirable suspecté.
Deuxième biosimilaire de FORSTEO disponible en France
TERROSA est le deuxième biosimilaire de FORSTEO 20 µg/80 µL solution injectable en stylo prérempli mis à disposition en France, après MOVYMIA 20 µg/80 µL solution injectable en cartouche (cf. notre article du 7 octobre 2019, actualisé le 15 avril et 2 octobre 2020).
Comme son médicament de référence, TERROSA est formulé à partir de tériparatide (20 µg/80 µL), produit sur Escherichia coli par la technique de l'ADN recombinant.
L'AMM européenne a été octroyée à TERROSA sur la base d'une étude d'équivalence pharmacocinétique entre TERROSA et FORSTEO (cf. Avis de la Commission de la Transparence du 15 avril 2020).
Aucune étude d'équivalence clinique n'a été fournie.
Deux présentations : une pour l'initiation de traitement, l'autre pour les renouvellements
Deux présentations de TERROSA sont proposées :
- en boîte de 1 cartouche fournie avec 1 stylo TERROSA PEN, à délivrer en initiation de traitement ;
- en boîte de 1 cartouche seule, à privilégier pour les renouvellements de traitement.
TERROSA en cartouche doit être utilisé uniquement avec le stylo TERROSA PEN.
TERROSA en pratique : posologie et manipulation du stylo TERROSA PEN
La posologie recommandée de TERROSA est de 20 µg 1 fois par jour, par injection sous-cutanée (SC).
Les sites d'injection recommandés sont la cuisse et l'abdomen. Une nouvelle aiguille doit être utilisée à chaque injection.
Les patients doivent être supplémentés en calcium et vitamine D si leurs apports alimentaires sont insuffisants.
La durée totale maximale de traitement avec le tériparatide prévue par l'AMM doit être de 24 mois (18 mois selon les recommandations de la HAS). Ce traitement de 24 mois par tériparatide ne doit pas être renouvelé au cours de la vie d'un patient. D'autres traitements de l'ostéoporose peuvent être utilisés par les patients après l'interruption du traitement par tériparatide.
Description du stylo TERROSA PEN
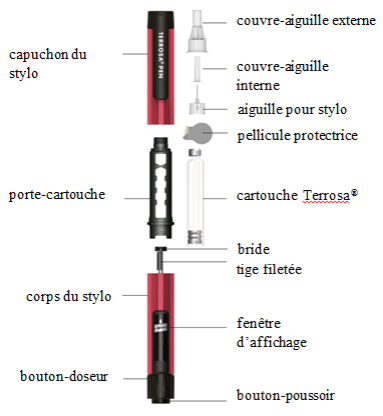 Le stylo TERROSA PEN est un système d'administration multidose réutilisable. Il se compose de 3 parties :
Le stylo TERROSA PEN est un système d'administration multidose réutilisable. Il se compose de 3 parties :
- le capuchon, qui protège le porte-cartouche ;
- le porte-cartouche, dans lequel doit être insérée la cartouche ;
- le corps du stylo, disposant d'une fenêtre d'affichage, et terminé par le bouton-doseur et le bouton-poussoir.
Pour chaque injection, une nouvelle aiguille doit être utilisée (cf. Encadré 1). Les aiguilles ne sont pas fournies dans le kit TERROSA.
TERROSA PEN est le seul stylo adapté à l'injection de TERROSA.
Encadré 1 - Aiguilles compatibles avec le stylo TERROSA PEN
|
Accompagnement des patients : injection, traçabilité et conservation
Les patients doivent être formés à l'injection SC avec le stylo TERROSA PEN.
En complément, des consignes de sécurité et de conservation doivent être soulignées :
- inscrire la date de la première injection sur la boîte de TERROSA, dans l'espace "Première utilisation" prévu à cet effet ;
- noter le numéro de lot et la date de première injection de chaque cartouche, sur un calendrier ;
- avant utilisation, conserver TERROSA au réfrigérateur, entre 2 et 8 °C ;
- une fois la cartouche insérée dans le stylo, l'ensemble cartouche/stylo doit être remis au réfrigérateur après chaque utilisation et utilisé dans un délai maximal de 28 jours (d'où l'importance d'inscrire la date de première utilisation sur la boîte de TERROSA) ;
- changer d'aiguille à chaque injection.
Identité administrative
- Liste I
- Boîte de 1 cartouche, CIP 3400930198209
- Boîte de 1 cartouche et 1 stylo TERROSA PEN, CIP 3400930198223
- Remboursable à 65 % selon la procédure des médicaments d'exception (Fiche d'information thérapeutique - Journal officiel du 24 novembre 2020 - texte 17)
- Prix public TTC = 232,71 euros (pour les deux présentations)
- Agrément aux collectivités (Journal officiel du 24 novembre - texte 18)
- Remboursement limité à 18 mois de traitement
- Inscription au groupe tériparatide sur la liste de référence des groupes biologiques similaires (ANSM, 18 août 2020)
- Laboratoire Arrow Génériques
Encadré 2 - Périmètre de remboursement de TERROSA
|
Pour aller plus loin
Avis de la Commission de la Transparence - TERROSA (HAS, 15 avril 2020)
Pour aller plus loin
Consultez les monographies VIDAL
Sources
Pour recevoir gratuitement toute l’actualité par mail Je m'abonne !

 4 minutes
4 minutes Ajouter un commentaire
Ajouter un commentaire





Commentaires
Cliquez ici pour revenir à l'accueil.