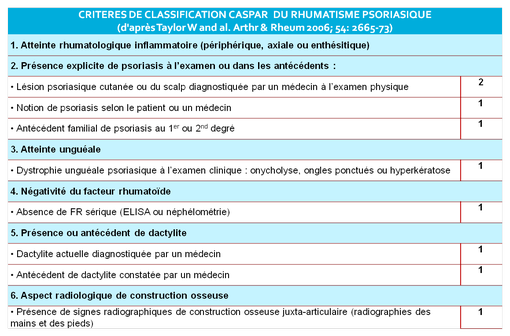
Pour retenir le diagnostic de rhumatisme psoriasique, il faut le critère 1 + au moins 3 points (illustration).
La prise en charge de l'inhibiteur des interleukines IL-12 et IL-23, STELARA 45 mg et 90 mg solution injectable SC en seringue préremplie (ustekinumab), est étendue au traitement du rhumatisme psoriasique actif chez l'adulte, seul ou en association avec le méthotrexate (MTX), lorsque la réponse à un précédent traitement de fond antirhumatismal non biologique (DMARD*) a été inadéquate.
* DMARD : Disease Modifying Anti-Rheumatic Drugs
Le taux de remboursement de STELARA est fixé à 65 %.
Son prix de vente au public s'élève à 2935,23 € TTC la seringue préremplie à 45 mg ou à 90 mg.
Pas de comparaison aux anti-TNF alfa : la place de STELARA dans la stratégie ne peut pas être précisée
STELARA a été autorisé dans le traitement du rhumatisme psoriasique en 2013.
Le traitement recommandé dans le rhumatisme psoriasique associe un traitement symptomatique (AINS avec ou sans antalgiques) à un traitement de fond conventionnel tel que le méthotrexate, le léflunomide et le sulfasalazine (hors AMM).
Les biothérapies sont proposées en seconde intention, lorsque l'activité de la maladie persiste malgré le traitement conventionnel.
Il s'agit des anti-TNF alfa (adalimumab, étanercept, infliximab, golimumab et certolizumab pégol), actifs sur les formes axiales et périphériques.
Dans son avis du 15 octobre 2014, la Commission de la transparence constate l'absence de données comparatives permettant de situer STELARA dans la stratégie thérapeutique par rapport aux anti-TNF alfa (comparateurs cliniquement pertinents).
En effet, l'indication de STELARA dans le rhumatisme psoriasique actif en seconde intention (malgré un traitement par AINS et/ou DMARD) repose sur deux études versus placebo, randomisées en double aveugle chez 927 patients dont 615 dans l'étude PSUMMIT 1 (McInnes and al. Lancet 2013 ; 82 : 780-9) et 312 dans l'étude PSUMMIT 2 (Ritchlin and al. Ann Rheum Dis 2014 ; 73 : 990-9).
Les données de ces études ont permis de démontrer :
- l'efficacité de STELARA versus placebo en termes de réponse ACR 20 (American college of rheumatology, critère de jugement principal, voir encadré 1) à la fois chez les patients naïfs d'anti-TNF et chez les patients ayant reçu un ou plusieurs anti-TNF ;
- la supériorité de STELARA versus placebo sur la progression de la destruction articulaire (critère secondaire) chez les patients naïfs d'anti-TNF mais pas chez les patients ayant préalablement reçu un ou plusieurs anti-TNF.
|
Amélioration d'au moins 20 % :
|
En termes de tolérance, le profil de l'ustekinumab dans le rhumatisme psoriasique est similaire à celui observé dans le psoriasis avec, comme événements indésirables les plus fréquemment observés, les infections, les vertiges, les céphalées, la fatigue, les diarrhées, les nausées, les myalgies, les arthralgies, le prurit, l'érythème et la douleur au site d'injection.
Sur la base de ces données, la Commission de la transparence a conclu à un rapport efficacité/effets indésirables moyen (SMR modéré) :
- avec une efficacité démontrée de l'ustekinumab versus placebo en seconde intention, seul ou en association avec le méthotrexate (MTX), dans les formes actives de rhumatisme psoriasique, réfractaires aux traitements de fond conventionnels incluant le MTX,
- mais sans démonstration de l'efficacité de ce principe actif sur la destruction articulaire en cas d'échec d'un ou plusieurs anti-TNF actif.
STELARA en pratique dans le rhumatisme psoriasique
La posologie recommandée de STELARA dans le rhumatisme psoriasique est la même que dans le traitement du psoriasis en plaque, à savoir :
- dose initiale de 45 mg administrée par voie sous-cutanée,
- suivie d'une dose de 45 mg 4 semaines plus tard,
- puis une dose toutes les 12 semaines.
L'arrêt du traitement doit être envisagé chez les patients ne présentant pas de réponse après 28 semaines de traitement.
Pour mémoire
L'ustekinumab est un anticorps monoclonal IgG. Il agit par inhibition des interleukines IL-12 et IL-23.
STELARA est également indiqué dans le traitement du psoriasis en plaques (Cf. Reco VIDAL Psoriasis en plaques de l'adulte) :
- traitement du psoriasis en plaques modéré à sévère chez l'adulte qui n'a pas répondu, ou qui présente une contre-indication, ou qui est intolérant aux autres traitements systémiques dont la ciclosporine, le méthotrexate (MTX) ou la puvathérapie (psoralène et UVA) ;
- traitement du psoriasis en plaques modéré à sévère chez l'adolescent âgé de 12 ans et plus, en cas de réponse insuffisante ou d'intolérance aux autres traitements systémiques ou aux photothérapies.
La prescription initiale de STELARA est hospitalière et annuelle. Cette prescription et son renouvellement sont réservés aux spécialistes en dermatologie, en médecine interne ou en rhumatologie.
STELARA est un médicament d'exception : la prescription doit être établie en conformité avec la fiche d'information thérapeutique (Journal officiel du 27 octobre 2015).
Pour aller plus loin
Avis de la Commission de la Transparence (HAS, 15 octobre 2015)
Arrêté du 21 octobre 2015 modifiant la liste des spécialités pharmaceutiques remboursables aux assurés sociaux - Fiche d'information thérapeutique (Journal officiel du 27 octobre 2015 - texte 10)
Arrêté du 21 octobre 2015 modifiant la liste des spécialités pharmaceutiques agréées à l'usage des collectivités (Journal officiel du 27 octobre 2015 - texte 11)
Avis relatif aux prix de spécialités pharmaceutiques (Journal officiel du 27 octobre 2015 - texte 70)
McInnes and al. Efficacy and safety of ustekinumab in patients with active psoriatic arthritis: 1 year results of the phase 3, multicentre, double-blind, placebo-controlled PSUMMIT 1 trial. Lancet 2013 ; 82 : 780-9.
Ritchlin C. and al. Efficacy and safety of the anti-IL-12/23 p40 monoclonal antibody, ustekinumab, in patients with active psoriatic arthritis despite conventional non-biological and biological anti-tumour necrosis factor therapy: 6-month and 1-year results of the phase 3, multicentre, double-blind, placebo-controlled, randomised PSUMMIT 2 trial. Ann Rheum Dis 2014 ; 73 : 990-9.
Pour aller plus loin
Consultez les monographies VIDAL
Sources
Pour recevoir gratuitement toute l’actualité par mail Je m'abonne !

 5 minutes
5 minutes Ajouter un commentaire
Ajouter un commentaire




Les commentaires sont momentanément désactivés
La publication de commentaires est momentanément indisponible.