Lymphocytes B (cytoplasme bleu et noyau violet) lors d'une leucémie lymphoïde chronique observés sur sang périphérique (illustration @VashiDonsk, sur Wikimedia).
Selon l'arrêté du 15 septembre 2015 publié au Journal officiel du 22 septembre 2015, l'anticancéreux ARZERRA solution à diluer pour perfusion (ofatumumab) est désormais agréé aux collectivités, en association avec le chlorambucil ou la bendamustine, dans le traitement des patients atteints d'une leucémie lymphoïde chronique (LLC), qui n'ont pas reçu de traitement préalable et qui ne sont pas éligibles à un traitement à base de fludarabine.
Les deux présentations d'ARZERRA, en flacon de 5 ml à 100 mg d'ofatumumab et en flacon de 50 ml à 1 000 mg d'ofatumumab, sont concernées.
Jusqu'à présent, la prise en charge d'ARZERRA était limitée au traitement de la LCC chez les patients réfractaires à la fludarabine et à l'alemtuzumab.
Amélioration de la médiane de survie sans progression
Pour rendre son avis relatif à l'agrément aux collectivités d'ARZERRA dans cette indication (avis du 3 juin 2015), la Commission de la transparence s'est appuyée sur les données d'efficacité et de tolérance de l'étude de phase III COMPLEMENT 1 (OMB110911) randomisée ouverte, en groupe parallèle, et multicentrique.
L'objectif principal de cette étude était de comparer l'efficacité de l'association ofatumumab/chlorambucil (OCHL, n = 221) à celle du chlorambucil en monothérapie (CHL, n = 226), en termes de survie sans progression à 12 mois, chez des patients atteints de LLC, non précédemment traités ou inéligibles à un traitement à base de fludarabine.
Cette étude est toujours en cours. Les résultats présentés correspondent aux données disponibles à la date du 20 mars 2013, permettant l'analyse du critère principal à 12 mois.
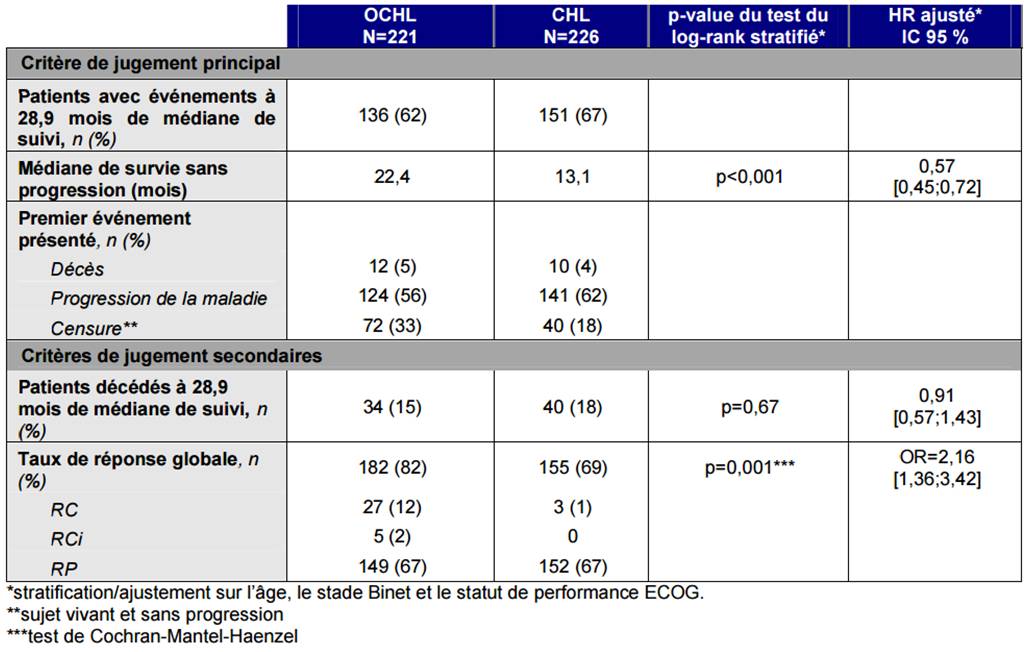
Selon les résultats de cette étude, la médiane de survie sans progression (critère principal) a été de 22,4 mois dans le groupe OCHL et de 13,1 mois dans le groupe CHL, soit un gain absolu de 9,3 mois en faveur du groupe OCHL (voir Tableau I).
Tableau I - Etude COMPLEMENT 1 - Résultats sur les critères de jugement
(extrait de l'avis de la Commission de la transparence du 3 juin 2015
(extrait de l'avis de la Commission de la transparence du 3 juin 2015
Les résultats d'une étude de phase II ouverte, non comparative et multicentrique (OMB115991), également en cours, ayant évalué l'association ofatumumab/bendamustine en termes de taux de réponse globale à 6 mois ont également été pris en compte.
Le critère de jugement principal était le taux de réponse globale (pourcentage de patients avec une réponse complète (RC), une réponse complète avec récupération médullaire incomplète (RCi), une réponse partielle nodulaire (nRP), ou une réponse partielle (RP) à la fin du traitement).
Après une durée médiane de suivi de 8,5 mois, le taux de réponse globale de l'association ofatumumab/ bendamustine pour les patients non préalablement traités et inéligibles à la fludarabine (n - 44) a été de 95 % (42/44 patients ; IC95% : [84,53 ; 99,44]), avec un taux de réponse complète de 43% (19/44 patients).
A la date du 28 février 2013, aucun décès n'a été rapporté et un patient a eu une progression de la maladie.
En termes de tolérance, les principaux événements indésirables de grades >= 3 ont été :
- dans l'étude COMPLEMENT 1 : des neutropénies, plus fréquentes dans le groupe OCHL (26 % versus 15 %), des thrombocytopénies, plus fréquentes dans le groupe CHL (5 % versus 10 %) et des anémies (5 % dans chaque groupe) ;
- dans l'étude de phase II, ce pourcentage a été de 57 %, principalement des neutropénies (36 %) et des éruptions cutanées (5 %).
Au vu de ces données, la Commission de la transparence considère qu'ARZERRA, en association au chlorambucil ou à la bendamustine, fait partie des traitements de première ligne des patients atteints d'une LLC inéligible à un traitement à base de fludarabine du fait de leurs comorbidités.
Elle a jugé le service médical rendu (SMR) d'ARZERRA important dans cette indication.
Prémédication par paracétamol, anti-histaminique et corticoïde
Le traitement par ofatumumab expose à des effets indésirables (réactions liées à la perfusion incluant un syndrome de relargage des cytokines, syndrome de lyse tumorale, LEMP, etc.).
Les patients doivent faire l'objet d'une surveillance étroite lors de l'administration de ce médicament.
Quelle que soit l'indication, une prémédication doit systématiquement être prescrite entre 30 minutes et 2 heures avant la perfusion d'ARZERRA.
Dans le cas d'une LLC non précédemment traitée, la prémédication comporte :
- du paracétamol par voie orale à la dose de 1000 mg (ou équivalent), ainsi que,
- un anti-histaminique par voie orale ou intraveineuse (50 mg de diphénhydramine ou 10 mg de cétirizine ou équivalent), ainsi que,
- un corticoïde par voie intraveineuse, tel que 50 mg de prednisolone ou équivalent (au lieu de 100 mg dans le cas d'une LLC réfractaire).
En pratique : une dose d'initiation à 300 mg suivie de dose à 1 000 mg d'ofatumumab
ARZERRA est injecté en perfusion intraveineuse et doit être dilué avant l'administration.
Dans le traitement de la LLC non préalablement traitée, le schéma posologique recommandé est le suivant :
- 300 mg le premier jour.
- La première perfusion d'ARZERRA doit être initiée à un débit de 12 ml/h.
- Pendant la perfusion, le débit doit être augmenté toutes les 30 minutes jusqu'à un maximum de 400 ml/h ;
- 1 000 mg une semaine plus tard, le huitième jour (cycle 1):
- en perfusion initiée à 25 ml/h,
- puis augmenté toutes les 30 minutes jusqu'à un maximum de 400 ml/h ;
- puis 1 000 mg le premier jour de chaque cycle suivant (une injection par mois).
En cas d'effets indésirables liés à la perfusion, l'administration doit être interrompue puis reprise à un débit réduit.
Pour mémoire
ARZERRA est un agent antinéoplasique composé d'un anticorps monoclonal humain (IgG1), l'ofatumumab.
Il est présenté en solution à diluer pour perfusion (20 mg/ml), en flacon de 5 ml contenant 100 mg d'ofatumumab ou en flacon de 50 ml contenant 1 000 mg d'ofatumumab.
Selon l'AMM (autorisation de mise sur le marché), ARZERRA est autorisé dans les indications suivantes :
- en association avec le chlorambucil ou la bendamustine, dans le traitement des patients atteints d'une LLC (leucémie lymphoïde chronique), qui n'ont pas reçu de traitement préalable et qui ne sont pas éligibles à un traitement à base de fludarabine ;
- dans le traitement de la LLC chez les patients réfractaires à la fludarabine et à l'alemtuzumab.
Sa prescription est réservée aux spécialistes en hématologie ou aux médecins compétents en maladies du sang.
Une surveillance particulière pendant le traitement est nécessaire.
Pour aller plus loin
Arrêté du 15 septembre 2015 modifiant la liste des spécialités pharmaceutiques agréées à l'usage des collectivités (Journal officiel, 22 septembre 2015 - texte 10)
Avis de la Commission de la Transparence (HAS, 3 juin 2015)
Pour recevoir gratuitement toute l’actualité par mail Je m'abonne !

 5 minutes
5 minutes Ajouter un commentaire
Ajouter un commentaire


Commentaires
Cliquez ici pour revenir à l'accueil.