Cellules T infectées par des VIH (illustration).
TRIUMEQ 50 mg/600 mg/300 mg comprimé pelliculé est une trithérapie orale contre l'infection par le VIH-1, composée d'une association fixe de 3 principes actifs antiviraux :
- 2 inhibiteurs nucléosidiques de la transcriptase inverse (INTI), l'abacavir et la lamivudine :
- chaque comprimé de TRIUMEQ contient 600 mg d'abacavir et 300 mg de lamivudine.
- pour mémoire, ces principes actifs entrent dans la composition de plusieurs médicaments déjà commercialisés en France, seuls ou en association, dont le médicament KIVEXA qui combine 600 mg d'abacavir et 300 mg de lamivudine ;
- 1 molécule de la classe des inhibiteurs d'intégrase (INI), le dolutégravir (50 mg par comprimé) : ce principe actif est disponible en France depuis 2014 dans le médicament TIVICAY 50 mg comprimé pelliculé (Cf. notre article du 16 avril 2014).
TRIUMEQ est indiqué dans le traitement de l'infection par le virus de l'immunodéficience humaine (VIH) chez les adultes et adolescents à partir de 12 ans, pesant au moins 40 kg.
Ce médicament fait l'objet d'une surveillance supplémentaire qui permettra l'identification rapide de nouvelles informations relatives à la sécurité. Les professionnels de santé déclarent tout effet indésirable suspecté.
Dépister l'allèle HLA-B*5701 chez TOUS les patients
L'abacavir et le dolutégravir sont associés à un risque de réactions d'hypersensibilité (fièvre, éruption cutanée…), qui ont été plus fréquemment observées avec l'abacavir.
| Il s'agit d'une réaction allergique retardée due aux lymphocytes T (réaction allergique de type IV selon la classification de Gell et Coombs, hypersensibilité retardée - HSR). La réaction d'hypersensibilité à l'abacavir est un effet indésirable fréquent (4,2 % des patients traités), survenant le plus souvent dans la phase initiale du traitement (6 premières semaines), se présentant en général avec rash cutané, fièvre, fatigue et symptômes respiratoires. Cette réaction peut entraîner un risque vital, particulièrement en cas de retrait tardif du médicament, ou encore en cas de réintroduction (0,03 % de mortalité). La réintroduction de l'abacavir est strictement contrindiquée après la survenue d'une RHS du fait du risque élevé de récidive grave (jusqu'à 35 % de réactions potentiellement mortelles). La vigilance du clinicien, ainsi que l'information du patient, sont donc déterminantes, le patient devant être informé des risques de survenue d'une RHS, de ses symptômes, ainsi que du risque de retraitement après avoir développé une RHS. Il est recommandé de réaliser un suivi étroit pendant les 2 mois suivant l'introduction de l'abacavir (1 consultation tous les 15 jours). |
Bien que des réactions d'hypersensibilité à l'abacavir aient été rapportées chez des patients non porteurs de l'allèle HLA-B*5701, ce risque est accru chez les patients porteurs de cet allèle : ainsi, les auteurs du rapport d'évaluation de la HAS (2009), indiquent que, selon l'étude PREDICT-1(1), "le portage de HLA B*5701 pour un patient donné multiplie par presque 10 sa probabilité de développer une réaction d'hypersensibilité à l'abacavir (elle passe de 7,8 % à 61 %)".
(1) Etude PREDICT-1 : essai randomisé en double aveugle multicentrique de1956 patients séropositifs susceptibles de recevoir un traitement contenant de l'abacavir, en double aveugle, prospectif et multicentrique, mené dans 265 centres en Europe et Australie entre avril et septembre 2006, non publié.
Le pourcentage de patients HIV positif porteurs de l'allèle HLA-B*5701 est de 5,3 % en France (Orkin C. et Coll. Pharmacogenet Genomiccs 2010).
| Avant de débuter un traitement contenant de l'abacavir, le dépistage de l'allèle HLA-B*5701 doit être réalisé chez TOUT patient infecté par le VIH, quelle que soit son origine ethnique. |
En présence de symptômes évocateurs d'une réaction d'hypersensibilité, le traitement doit être interrompu.
Données cliniques d'efficacité : reprise des études menées avec TIVICAY
Les données cliniques de l'évaluation de TRIUMEQ par la Commission de la transparence (avis du 17 décembre 2014) reposent sur des essais appartenant au programme de développement clinique de TIVICAY (dolutégravir 50 mg).
S'agissant des patients naïfs de traitement, il s'agit principalement l'essai de phase III SINGLE ainsi que les résultats des sous-groupes des études SPRING-2 et FLAMMINGO (voir Tableau 1 ci-dessous) :
Tableau 1 : Etudes du programme de développement de TIVICAY (dolutégravir) portant sur l'association libre de cette spécialité avec KIVEXIA (abacavir/lamivudine) chez les patients naïfs de traitement
(extrait de l'avis de la CT du 17 décembre 2014)
(extrait de l'avis de la CT du 17 décembre 2014)
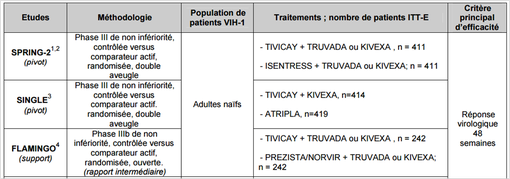
Les résultats de ces études ont montré que, chez les patients naïfs de traitement antirétroviral et en association à deux INTI (KIVEXIA ou TRUVADA), TIVICAY (dolutegravir) était non inférieur à ISENTRESS (raltégravir) et PREZISTA (darunavir/ritonavir), en termes de réponse virologique à 48 semaines de traitement.
Concernant les patients prétraités dont le virus ne possède pas de mutation de résistance aux INI, aucune données n'étant disponible pour l'association libre ou fixe des composants de TRIUMEQ, son efficacité a été extrapolée à partir des données d'efficacité déjà connues pour ses composants (TIVICAY et KIVEXA).
L'autorisation de mise sur le marché de TRIUMEQ (AMM) a été obtenue sur la base de ces études ainsi que sur une étude de pharmacocinétique qui a démontré la bioéquivalence entre TRIUMEQ et l'administration séparée de ses différents composants.
Aucune étude clinique n'a évalué l'efficacité de l'association fixe TRIUMEQ.
En termes de tolérance, les données cliniques disponibles avec TRIUMEQ sont limitées.
Les études de phase III du programme de développement clinique de TIVICAY chez le patient naïf de traitement antirétroviral ont montré un profil de tolérance favorable de l'association libre TIVICAY + KIVEXA.
Les événements indésirables les plus fréquemment rapportés (>= 5 %) liés à cette association ont été les nausées (11%), les insomnies (7%), les céphalées et les sensations vertigineuses (6% chacun), les diarrhées et l'asthénie (5% chacun).
Place dans la stratégie thérapeutique : simplification thérapeutique
Dans son avis du 17 décembre 2014, la Commission de la Transparence a considéré que le SMR (service médical rendu) de TRIUMEQ était important (voir encadré ci-dessous).
| "La trithérapie abacavir/lamivudine (KIVEXA) + dolutégravir (TIVICAY) fait partie des options thérapeutiques préférentielles recommandées dans la prise en charge des patients infectés par le VIH. La spécialité TRIUMEQ (association fixe abacavir/lamivudine + dolutégravir) permet donc une simplification thérapeutique lorsque la prescription de cette trithérapie est envisagée chez le patient naïf ou prétraité dont le virus ne possède pas de mutation de résistance aux inhibiteurs de l'intégrase et aux deux INTI (abacavir et lamivudine) de l'association fixe". |
En pratique : une seule prise quotidienne, sans adaptation possible de la posologie
La posologie quotidienne de TRIUMEQ est de 1 comprimé 1 fois par jour.
Le comprimé peut être pris avec ou sans nourriture.
TRIUMEQ est une association fixe qui ne permet pas d'adaptation de la posologie.
Chaque substance active (dolutégravir, abacavir ou lamivudine) est disponible séparément, seule ou en association selon les médicaments, au cas où une interruption du traitement ou un ajustement de la posologie de l'une des substances actives est nécessaire.
TRIUMEQ n'est pas recommandé dans les situations nécessitant une posologie de dolutégravir de 50 mg 2 fois par jour, c'est-à-dire :
- chez les patients présentant une résistance à la classe des inhibiteurs d'intégrase ;
- chez les patients traités de façon concomitante par éfavirenz, névirapine, rifampicine ou par l'association tipranavir/ritonavir.
Conseil aux patients : attention aux associations médicamenteuses
Si le patient oublie de prendre une dose de TRIUMEQ, deux situations peuvent se présenter :
- s'il reste plus de 4 heures avant la dose suivante, le patient doit prendre le comprimé oublié dès que possible ;
- s'il reste moins de 4 heures avant la prise suivante, la dose oubliée ne doit pas être prise et le patient doit simplement poursuivre son traitement habituel.
La prise de certains médicaments disponibles sans ordonnance impose des précautions d'emploi :
- les antiacides à base de magnésium ou d'aluminium : ces médicaments ne doivent pas être coadministrés avec TRIUMEQ. Il est recommandé de prendre TRIUMEQ 2 heures avant ou 6 heures après la prise de ces médicaments ;
- les suppléments en calcium, en fer ou compléments multivitaminés : ces médicaments doivent être pris à distance de TRIUMEQ, au moins 2 heures après ou 6 heures avant ;
- l'administration concomitante de millepertuis est fortement déconseillée.
Les patients traités par metformine doivent être surveillés et une adaptation posologique de la metformine peut être nécessaire. En effet, le dolutégravir peut entraîner une augmentation plasmatique des concentrations de metformine.
Identité administrative
- Liste I
- Prescription initiale hospitalière annuelle
- Renouvellement non restreint
- Flacon de 30, CIP 3400927948954
- Remboursable à 100 % dans le traitement de l'infection par le VIH-1 des adultes et adolescents à partir de 12 ans non porteurs de l'allèle HLA B* 5701 et dont le virus ne possède pas de mutation de résistance aux inhibiteurs de l'intégrase et aux deux INTI (abacavir et lamivudine) (Journal officiel du 3 juin 2015 - texte 17)
- Prix public TTC = 928,71 euros
- Agrément aux collectivités dans le traitement de l'infection par le VIH-1 des adultes et adolescents à partir de 12 ans non porteurs de l'allèle HLA B* 5701 et dont le virus ne possède pas de mutation de résistance aux inhibiteurs de l'intégrase et aux deux INTI (abacavir et lamivudine) (Journal officiel du 3 juin 2015 - texte 18)
- Inscrit sur la liste de rétrocession avec prise en charge à 100 %, UCD 3400894078265 (Journal officiel du 30 juin 2015 - texte 61)
- Laboratoire VIIV Healthcare
Pour aller plus loin
Avis de la Commission de la Transparence (HAS, 17 décembre 2014)
Plan européen de gestion des risques (EMA, mise à jour du 8 juin 2015)
Sur Vidal.fr
TIVICAY (dolutégravir) : nouveau principe actif dans la prise en charge de l'infection par le VIH (16 avril 2014)
Pour aller plus loin
Consultez les monographies VIDAL
Consultez les VIDAL Recos
Sources
Pour recevoir gratuitement toute l’actualité par mail Je m'abonne !

 7 minutes
7 minutes Ajouter un commentaire
Ajouter un commentaire




Les commentaires sont momentanément désactivés
La publication de commentaires est momentanément indisponible.