Lésions de kératose actinique sur la peau du crâne d'un homme chauve (illustration @Future FamDoc sur Wikimedia).
Résumé
TOLAK 40 mg/g crème est une nouvelle spécialité topique de fluorouracil (5-FU).
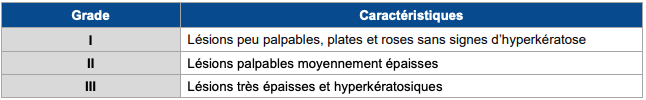
Elle est indiquée dans le traitement topique de la kératose actinique non hyperkératosique et non hypertrophique (grade Olsen I à II) du visage, des oreilles et/ou du cuir chevelu chez l'adulte.
TOLAK n'est pas un générique d'EFUDIX 5 % crème. Elle s'en distingue par :
Une réaction inflammatoire localisée au niveau des lésions apparaît pendant le traitement. Les symptômes disparaissent en 2 à 4 semaines après la fin du traitement.
En raison du risque de photosensibilisation, les patients ne doivent pas s'exposer au soleil ou aux rayons UV artificiels pendant le traitement.
TOLAK est un médicament de prescription médicale obligatoire. Il est agréé aux collectivités et remboursable à 15 %. Son prix public (hors honoraires de dispensation) s'élève à 30,04 euros TTC (1 tube de 20 g).
TOLAK 40 mg/g crème est une nouvelle spécialité topique de fluorouracil (5-FU).
Elle est indiquée dans le traitement topique de la kératose actinique non hyperkératosique et non hypertrophique (grade Olsen I à II) du visage, des oreilles et/ou du cuir chevelu chez l'adulte.
TOLAK n'est pas un générique d'EFUDIX 5 % crème. Elle s'en distingue par :
- un dosage plus faible, à 4 % de 5-FU ;
- une posologie moindre, de une application par jour, versus une à deux applications par jour pour EFUDIX.
Une réaction inflammatoire localisée au niveau des lésions apparaît pendant le traitement. Les symptômes disparaissent en 2 à 4 semaines après la fin du traitement.
En raison du risque de photosensibilisation, les patients ne doivent pas s'exposer au soleil ou aux rayons UV artificiels pendant le traitement.
TOLAK est un médicament de prescription médicale obligatoire. Il est agréé aux collectivités et remboursable à 15 %. Son prix public (hors honoraires de dispensation) s'élève à 30,04 euros TTC (1 tube de 20 g).
En dermatologie, une nouvelle spécialité topique à base de fluorouracil (5-FU) est mise sur le marché, à l'officine et à l'hôpital :
- TOLAK 40 mg/g crème
Tableau - Classification d'Olsen [1]
Évaluation médico-économique de TOLAK : un SMR faible
La Commission de la transparence (CT) a étudié la demande de prise en charge de TOLAK en 2020.
Dans un avis du 21 octobre 2020 [1], elle a attribué à ce médicament :
- un service médical rendu (SMR) faible ;
- sans amélioration du service médical rendu (ASMR) par rapport à EFFUDIX 5 % crème, autre spécialité topique à base de 5-FU disponible en France et considérée comme un comparateur pertinent.
TOLAK supérieur au placebo, mais pas non inférieur à EFUDIX en termes de disparition complète des lésions
À l'appui de sa décision, la CT a pris en compte :
- la démonstration de la supériorité de TOLAK versus placebo dans l'étude de phase III HD-FUP3S-049, en termes de disparition complète des lésions quatre semaines après l'arrêt du traitement ;
- d'une durée de quatre semaines (critère de jugement principal) avec une quantité d'effet importante (cf. Encadré ci-dessous) ;
- et l'absence de démonstration de non-infériorité de TOLAK par rapport à EFUDIX 5 % crème dans l'étude de phase III HD-FUP3B-048, en termes de disparition complète des lésions 4 semaines après l'arrêt du traitement d'une durée de 4 semaines (critère de jugement principal).
Encadré - Résultats des études de supériorité TOLAK versus placebo
La supériorité du 5-FU 4 % (TOLAK) par rapport au placebo a été démontrée en termes de disparition complète des lésions quatre semaines après l'arrêt du traitement (soit à la semaine 8) :
|
Place de TOLAK dans la stratégie thérapeutique : une teneur réduite en 5-FU, mais sans démonstration de meilleure tolérance par rapport à EFUDIX
En comparaison à EFUDIX, la spécialité TOLAK :
- est moins dosée en 5-FU : 4 % dans TOLAK contre 5 % pour EFUDIX ;
- présente une posologie réduite, à raison d'une application par jour, contre 1 à 2 applications pour EFUDIX.
Pour la CT, TOLAK 40 mg/g crème est une alternative à la cryothérapie en cas de lésions multiples de kératose actinique, non hyperkératosique et non hypertrophique (grade Olsen I à II) du visage, des oreilles et/ou du cuir chevelu chez l'adulte, mais sa place dans la stratégie thérapeutique ne peut être précisée par rapport aux autres alternatives disponibles, dont EFUDIX, faute de démonstration de sa non-infériorité versus ce traitement.
TOLAK en pratique
La posologie recommandée de TOLAK est de 1 application par jour « en quantité suffisante pour couvrir toute la zone de peau affectée du visage et/ou des oreilles et/ou du cuir chevelu sur laquelle des lésions de KA ont été identifiées ».
Les consignes d'application sont les suivantes :
- avant l'application, laver, rincer et sécher les zones à traiter ;
- appliquer la crème en couche fine ;
- utiliser le bout des doigts pour masser doucement afin de faire pénétrer de manière uniforme le médicament dans la peau ;
- se laver soigneusement les mains après application.
D'ailleurs, une fois le tube ouvert, la durée de conservation est de 4 semaines.
La répétition des traitements par TOLAK n'a pas été évaluée. Dans les études cliniques, l'intervalle entre le traitement initial et le retraitement par TOLAK était de 7 à 13 mois. Le nombre de retraitements par TOLAK est laissé à la discrétion du médecin responsable du traitement.
Inflammation localisée : prévenir les patients
L'application de 5-FU sur les lésions provoque une inflammation localisée se manifestant par des réactions cutanées telles qu'un érythème, une desquamation, une formation de croûtes, un prurit, une sensation de brûlure, un œdème et des érosions.
Ces réactions locales sont passagères et disparaissent en 2 à 4 semaines après la fin du traitement.
En cas de gêne sévère au cours du traitement ou de réactions cutanées durant plus de 4 semaines, un traitement symptomatique (tel qu'un émollient ou des corticoïdes topiques) peut être proposé.
Déficit en dihydropyrimidine déshydrogénase (DPD)
Depuis 2019, la dispensation et l'administration des spécialités injectables à base de 5-FU indiquées en chimiothérapie sont conditionnées à la réalisation d'un test recherchant un déficit en dihydropyrimidine déshydrogénase (DPD) (cf. notre dernier article sur le sujet, du 29 septembre 2021). Cette démarche vise à réduire les situations de toxicité associées aux fluoropyrimidines.
La recherche en DPD ne concerne pas la forme topique. Cependant, les patients présentant un déficit connu en DPD doivent faire l'objet d'une surveillance intensive visant à identifier les signes et symptômes d'une toxicité systémique au cours du traitement par 5-FU topique.
Photosensibilisation : ne pas s'exposer au soleil
Le 5-FU topique est associé à des réactions de photosensibilité.
L'exposition au rayonnement ultraviolet, notamment par l'exposition à la lumière du soleil ou par l'utilisation de lampes solaires ou de lits de bronzage, doit être évitée au cours du traitement par TOLAK.
Pour aller plus loin
Liste I
Tube de 20 g, CIP 3400930193266
Remboursable à 15 % (Journal officiel du 12 avril 2022 - texte 20)
Prix public TTC = 30,04 euros
Agrément aux collectivités (Journal officiel du 12 avril 2022 - texte 20)
Laboratoire Pierre Fabre Dermatologie
Pour aller plus loin
[1] Avis de la Commission de la transparence - TOLAK (HAS, 21 octobre 2020)
Pour aller plus loin
Consultez les monographies VIDAL
Sources
Pour recevoir gratuitement toute l’actualité par mail Je m'abonne !

 5 minutes
5 minutes Ajouter un commentaire
Ajouter un commentaire





Commentaires
Cliquez ici pour revenir à l'accueil.