Les données sur l'activité antivirale in vitro du PF-07321332 contre le variant Omicron suggèrent en l'état une activité conservée vis-à-vis du variant Omicron (illustration).
Résumé
La Haute Autorité de santé (HAS) a autorisé l'utilisation en accès précoce du premier médicament antiviral dirigé contre le virus SARS-CoV-2, PAXLOVID comprimés, dans le traitement curatif des adultes positifs au COVID-19 et à risque de développer une forme grave :
EDIT du 31 janvier 2022 : la Commission européenne a accordé une autorisation de mise sur le marché (AMM) conditionnelle à PAXLOVID. Selon l'ANSM, PAXLOVID sera disponible en France en février 2022. /FIN EDIT
PAXLOVID vient compléter l'arsenal thérapeutique curatif de la COVID-19, composé principalement d'anticorps monoclonaux. En outre, seul l'anticorps monoclonal XEVUDY (sotrovimab) conserve une activité neutralisante sur le variant Omicron et peut être indiqué en traitement curatif, d'où la nécessité selon la HAS de disposer d'autres alternatives.
PAXLOVID associe deux antiviraux, dans des comprimés distincts :
La posologie est de 2 comprimés de nirmatrelvir (300 mg) + 1 comprimé de ritonavir (100 mg) 2 fois par jour, à 12 heures d'intervalle.
Le traitement doit être initié le plus rapidement possible suivant l'apparition des symptômes, et conduit pendant 5 jours.
PAXLOVID est contre-indiqué dans les situations suivantes :
Du fait de la forme per os de PAXLOVID et de son efficacité pour réduire le risque d'hospitalisation et de décès (de plus de 85 %), la HAS recommande sa mise à disposition dans le circuit ambulatoire, avec prescription possible par le médecin traitant. Pour accompagner les professionnels de santé dans l'utilisation de cet antiviral, elle a élaboré 5 réponses rapides. Ce document synthétique précise notamment :
La mise à disposition de PAXLOVID est prévue fin janvier 2022.
EDIT du 27 janvier 2022 : l'arrêté du 26 janvier 2022 autorise, à titre dérogatoire, la prescription par les médecins libéraux et la dispensation par les pharmaciens d'officine des traitements antiviraux anti-COVID par voie orale, dont PAXLOVID (seul médicament de cette catégorie disponible en France à la date du 27 janvier 2022). Le pharmacien d'officine qui dispense respecte les obligations prévues par le protocole d'utilisation thérapeutique et de recueil des données /FIN EDIT.
La Haute Autorité de santé (HAS) a autorisé l'utilisation en accès précoce du premier médicament antiviral dirigé contre le virus SARS-CoV-2, PAXLOVID comprimés, dans le traitement curatif des adultes positifs au COVID-19 et à risque de développer une forme grave :
- traitement de la COVID-19 chez les adultes ne nécessitant pas d'oxygénothérapie et étant à risque élevé d'évolution vers une forme grave de la COVID-19.
EDIT du 31 janvier 2022 : la Commission européenne a accordé une autorisation de mise sur le marché (AMM) conditionnelle à PAXLOVID. Selon l'ANSM, PAXLOVID sera disponible en France en février 2022. /FIN EDIT
PAXLOVID vient compléter l'arsenal thérapeutique curatif de la COVID-19, composé principalement d'anticorps monoclonaux. En outre, seul l'anticorps monoclonal XEVUDY (sotrovimab) conserve une activité neutralisante sur le variant Omicron et peut être indiqué en traitement curatif, d'où la nécessité selon la HAS de disposer d'autres alternatives.
PAXLOVID associe deux antiviraux, dans des comprimés distincts :
- comprimé de nirmatrelvir, 150 mg : ce nouvel antiviral inhibe l'action de la protéase 3C-like et bloque la réplication du virus SARS-CoV-2 ;
- comprimé de ritonavir, 100 mg : le ritonavir est utilisé pour augmenter les concentrations plasmatiques du nirmatrelvir, dont la demi-vie est courte.
La posologie est de 2 comprimés de nirmatrelvir (300 mg) + 1 comprimé de ritonavir (100 mg) 2 fois par jour, à 12 heures d'intervalle.
Le traitement doit être initié le plus rapidement possible suivant l'apparition des symptômes, et conduit pendant 5 jours.
PAXLOVID est contre-indiqué dans les situations suivantes :
- insuffisance hépatique sévère ;
- insuffisance rénale sévère ;
- prise de médicaments puissants inducteurs ou dont le métabolisme dépend fortement du CYPA3.
Du fait de la forme per os de PAXLOVID et de son efficacité pour réduire le risque d'hospitalisation et de décès (de plus de 85 %), la HAS recommande sa mise à disposition dans le circuit ambulatoire, avec prescription possible par le médecin traitant. Pour accompagner les professionnels de santé dans l'utilisation de cet antiviral, elle a élaboré 5 réponses rapides. Ce document synthétique précise notamment :
- les patients adultes considérés à risque de forme grave de COVID-19, pour lesquels PAXLOVID peut être envisagé ;
- les contre-indications médicamenteuses à PAXLOVID.
La mise à disposition de PAXLOVID est prévue fin janvier 2022.
EDIT du 27 janvier 2022 : l'arrêté du 26 janvier 2022 autorise, à titre dérogatoire, la prescription par les médecins libéraux et la dispensation par les pharmaciens d'officine des traitements antiviraux anti-COVID par voie orale, dont PAXLOVID (seul médicament de cette catégorie disponible en France à la date du 27 janvier 2022). Le pharmacien d'officine qui dispense respecte les obligations prévues par le protocole d'utilisation thérapeutique et de recueil des données /FIN EDIT.
Un nouveau médicament vient de recevoir une autorisation d'accès précoce dans le traitement curatif de la COVID-19, en France :
- PAXLOVID comprimés (nirmatrelvir/ritonavir)
Cet accès précoce, octroyé le 20 janvier 2022 par la Haute Autorité de santé (HAS), est prévu pour le traitement de la COVID-19 chez les adultes ne nécessitant pas d'oxygénothérapie et étant à risque élevé d'évolution vers une forme grave de la COVID-19 (cf. Encadré ci-dessous).
Cette indication correspond à celle approuvée par l'Agence européenne du médicament (EMA) en décembre 2021.
La mise à disposition des premières doses de PAXLOVID sur le marché français est prévue fin janvier 2022 (en attente des détails de commandes et de livraison communiqués par la Direction générale de la Santé).
EDIT du 31 janvier 2022 : la Commission européenne a accordé une autorisation de mise sur le marché (AMM) conditionnelle à PAXLOVID. Selon l'ANSM, PAXLOVID sera disponible en France en février 2022. /FIN EDIT
EDIT du 27 janvier 2022 : l'arrêté du 26 janvier 2022 autorise, à titre dérogatoire, la prescription par les médecins libéraux et la dispensation par les pharmaciens d'officine des traitements antiviraux anti-COVID par voie orale, dont PAXLOVID (seul médicament de cette catégorie disponible en France à la date du 27 janvier 2022). Le pharmacien d'officine qui dispense respecte les obligations prévues par le protocole d'utilisation thérapeutique et de recueil des données.
La dispensation et le recueil de données sont facturés 9,22 euros TTC en métropole (tarif majoré pour l'outremer).
La participation des médecins libéraux à la prescription et au suivi du traitement est valorisée pour la prescription initiale de PAXLOVID dans le cadre d'une consultation seule ou avec la réalisation d'un test antigénique de détection du SARS-CoV-2 (respectivement C 1,32 et C 1,95). /FIN EDIT.
Encadré - Liste des personnes concernées en premier lieu par PAXLOVID (risque élevé d'évolution vers une forme grave), en l'absence de contre-indications
|
PAXLOVID : un antiviral dirigé contre le SARS-CoV-2
PAXLOVID se présente sous forme de comprimés pour administration orale.
Il s'agit du premier antiviral anti-SARS-CoV-2 qui obtient une autorisation d'accès précoce en France. PAXLOVID représente ainsi une alternative aux anticorps monoclonaux, dans le traitement curatif de la COVID-19.
Deux antiviraux dans des comprimés distincts, mais nécessitant une coadministration
Les deux antiviraux de PAXLOVID sont formulés dans des comprimés distincts :
- comprimé de nirmatrelvir PF-07321332 (150 mg par comprimé) ;
- comprimé de ritonavir (100 mg par comprimé).
Le ritonavir est utilisé comme puissant inhibiteur enzymatique du cytochrome P450, pour augmenter les concentrations plasmatiques de PF-07321332 (nirmatrelvir), dont la demi-vie d'élimination terminale est courte (4-5 h).
En association avec le ritonavir, la demi-vie d'élimination moyenne du nirmatrelvir est de 6,1 heures.
Si PF-07321332 n'est pas correctement coadministré avec le ritonavir, ses concentrations plasmatiques seront insuffisantes pour obtenir l'effet thérapeutique souhaité.
Une efficacité de plus de 85 % sur les complications (hospitalisation et décès)
L'efficacité et la tolérance de PAXLOVID ont été évaluées dans l'étude de phase II/III EPIC-HR, de supériorité, multicentrique, randomisée, en double aveugle, en groupe parallèles, contrôlée versus placebo, réalisée chez 3 100 patients adultes symptomatiques non hospitalisés pour lesquels un diagnostic d'infection à SARS-CoV-2 a été confirmé en laboratoire.
Le critère de jugement principal a été le taux d'hospitalisation en raison de la COVID-19 ou de décès toutes causes à J28. La durée totale du suivi a été de 24 semaines (fin de l'étude).
L'analyse finale du critère de jugement principal a été réalisée sur la population mITT, à savoir l'ensemble des patients randomisés ayant reçu au moins une dose de traitement, avec au moins une visite postinclusion jusqu'à J28, traités dans les 3 jours après le début des symptômes du COVID et n'ayant pas reçu ni devant recevoir de traitement par anticorps monoclonal anti-COVID.
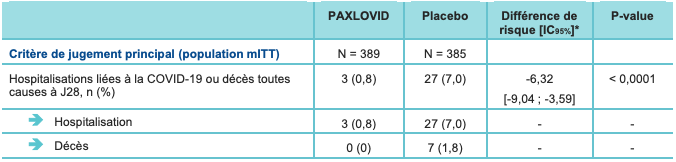
Les résultats de l'analyse intermédiaire (confirmés par la présentation préliminaire des données actualisées) montrent une réduction significative de l'incidence des hospitalisations liées à la COVID-19 ou décès toutes causes à J28 (cf. Tableau I) :
- chez les patients qui ont été traités dans les 3 jours suivant l'apparition des symptômes (population mITT) : 0,8 % versus 7,0 % ; avec une différence ajustée de -6,3 IC95% : [-9,04 ; -3,59] ; p < 0,0001 ; soit une réduction du risque relatif de 89,1 % ;
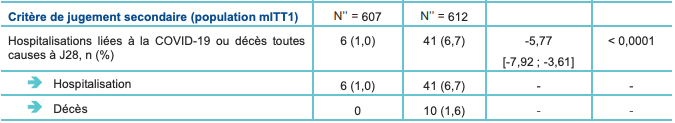
- chez les patients qui ont été traités dans les 5 jours suivant l'apparition des symptômes (population mITT1 - critère de jugement secondaire) : 1,0 % versus 6,7 % ; avec une différence ajustée de -5,76 % ; IC95% : [-7,92 ; -3,61] ; p < 0,0001 ; soit une réduction du risque relatif de 85,2 %. À noter que l'analyse dans la population mITT1 est considérée comme plus représentative de la population d'intérêt (traitement instauré dans les 5 jours suivant l'apparition des symptômes et la recommandation posologique).
Tableau I - Résultats du critère de jugement principal et de l'un des critères de jugement secondaires - analyse intermédiaire
* La proportion cumulative de participants hospitalisés pour le traitement de la COVID-19 ou décédés au cours des 28 premiers jours de l'étude a été estimée pour chaque groupe de traitement en utilisant la méthode Kaplan-Meier.
In vitro, les données montrent une activité antivirale de PF-07321332 en culture cellulaire contre les isolats de SARS-CoV-2 appartenant aux classes Alpha (B.1.1.7), Bêta (B.1.351), Gamma (P.1), Delta (B.1.617.2) et Lambda (C.37).
Des données sur l'activité antivirale in vitro du PF-07321332 contre le variant Omicron sont en cours d'évaluation : elles suggèrent en l'état une activité conservée vis-à-vis du variant Omicron.
PAXLOVID : les arguments en faveur de l'autorisation d'accès précoce
Dans sa décision du 20 janvier 2022 autorisant l'accès précoce pour PAXLOVID, la HAS s'est appuyée sur :
- l'avis favorable de l'Agence nationale de sécurité du médicament et des produits de santé (ANSM) sur la présomption d'efficacité et de sécurité de PAXLOVID ;
- la présomption du caractère innovant de PAXLOVID (l'innovation est un critère d'attribution de l'accès précoce) ;
- son administration par voie orale permettant une utilisation de ce médicament en ambulatoire (pour rappel, les anticorps monoclonaux sont injectables) ;
- la nécessité de disposer d'un médicament efficace en curatif, alors que tous les anticorps monoclonaux disponibles en France sauf XEVUDY (cf. notre article du 11 janvier 2022) ont perdu leur activité neutralisante vis-à-vis du variant Omicron.
PAXLOVID en pratique
PAXLOVID dans la stratégie anti-COVID-19 : un complément au vaccin pour les personnes vulnérables
La HAS rappelle que PAXLOVID ne remplace pas la vaccination, qui reste le traitement de référence dans la lutte contre la COVID-19. PAXLOVID n'est donc pas destiné à être utilisé comme substitut à la vaccination contre le SARS-CoV-2.
Au plus tard dans les 5 jours et à commencer le plus tôt possible
PAXLOVID doit être administré dès que possible après le diagnostic positif à la COVID-19, et au maximum dans les 5 jours suivant l'apparition des symptômes.
En traitement curatif chez des personnes infectées par le SARS-CoV-2 et à risque d'évolution vers une forme grave, le schéma posologique recommandé est de 3 comprimés à prendre concomitamment par voie orale 2 fois par jour toutes les 12 heures, pendant 5 jours :
- 2 comprimés de nirmatrelvir, soit 300 mg ;
- 1 comprimé de ritonavir, soit 100 mg.
Contre-indications au médicament PAXLOVID et consignes à suivre
PAXLOVID est contre-indiqué :
- chez les personnes avec une insuffisance hépatique sévère (classe C de Child Pugh) ;
- chez les personnes avec une insuffisance rénale sévère (DFG < 30 mL/min) ;
- avec les médicaments dont le métabolisme dépend fortement du CYPA3 (cf. Tableau II) ;
- avec les médicaments puissants inducteurs du CYPA3, en raison du risque de réduction des concentrations plasmatique et d'un risque consécutif de perte de réponse virologique et de résistance potentielle (cf. Tableau II).
Pour certains médicaments (cf. Liste HAS), un arrêt transitoire ou une adaptation de la posologie associée à une surveillance rapprochée sont nécessaires en cas d'association avec PAXLOVID. Selon la HAS, « il revient au médecin d'apprécier avec son patient les contre-indications médicamenteuses à l'utilisation de PAXLOVID ».
En cas d'insuffisance rénale modérée, la posologie doit être adaptée :
- 1 seul comprimé de nirmatrelvir + 1 comprimé de ritonavir, toutes les 12 heures.
Tableau II - Médicaments dont l'utilisation concomitante avec PAXLOVID est contre-indiquée (source HAS)
| Classe thérapeutique | Médicaments de la classe thérapeutique |
| Augmentation ou diminution des concentrations du médicament concomitant | |
| Antagonistes des récepteurs adrénergiques alpha-1 | Alfuzosine |
| Analgésiques | Péthidine piroxicam propoxyphène |
| Antiangoreux | Ranolazine |
| Anticancéreux | Nératinib Vénétoclax |
| Antiarythmiques | Amiodarone, bépridil, dronédarone, encaïnide, flécaïnide, propafénone, quinidine |
| Antigoutteux | Colchicine |
| Antihistaminiques | Astémizole, terfénadine |
| Antipsychotiques/Neuroleptiques | Lurasidone Clozapine, pimozide Quétiapine |
| Dérivés de l'ergot de seigle | Dihydroergotamine, ergonovine, ergotamine, méthylergonovine |
| Antibiotiques | Acide fusidique |
| Hypolipémiants | Lovastatine, simvastatine Lomitapide |
| Inhibiteur de la PDE5 (phosphodiestérase cGMP-spécifique de type 5) | Avanafil Sildénafil Vardénafil |
| Sédatifs/hypnotiques | Clorazépate, diazépam, estazolam, flurazépam, midazolam oral et triazolam |
| Diminution des concentrations de nirmatrelvir/ritonavir | |
| Préparations à base de plantes | Millepertuis |
| Anticonvulsivants | Carbamazépine |
| Anti-infectieux | Rifampicine |
Accompagner la mise à disposition en ville : des réponses rapides pour garantir le bon usage de PAXLOVID
La mise à disposition de PAXLOVID est prévue en ambulatoire, avec une prescription ouverte aux médecins généralistes.
La HAS a élaboré des Réponses rapides pour accompagner l'utilisation de PAXLOVID en médecine de ville.
Les trois premières réponses rapides traitent de l'indication, de la posologie et des critères d'éligibilité au traitement par PAXLOVID.
Les réponses rapides 4 et 5 précisent les situations de contre-indication ou les situations devant faire l'objet d'un ajustement posologique et d'une surveillance.
Pour aller plus loin
Communiqué de presse - Covid-19 : accès précoce accordé au Paxlovid® en traitement curatif (HAS, 21 janvier 2022)
Décision n° 2022.0023/DC/SEM du 20 janvier 2022 du collège de la Haute Autorité de santé portant autorisation d'accès précoce de la spécialité PAXLOVID (HAS, 20 janvier 2022)
Réponses rapides - Traitement par antiviral des patients à risque de forme grave de la Covid-19 (HAS, 21 janvier 2022)
EDIT du 27 janvier 2022 : Arrêté du 26 janvier 2022 modifiant l'arrêté du 1er juin 2021 prescrivant les mesures générales nécessaires à la gestion de la crise sanitaire (Journal officiel du 27 janvier 2022 - texte 23) /FIN EDIT
EDIT du 31 janvier 2022 : Traitements contre la COVID-19 : la Commission européenne accorde une autorisation de mise sur le marché au PAXLOVID (ANSM, 31 janvier 2022) /FIN EDIT
Sources
Pour recevoir gratuitement toute l’actualité par mail Je m'abonne !

 9 minutes
9 minutes Ajouter un commentaire
Ajouter un commentaire






Les commentaires sont momentanément désactivés
La publication de commentaires est momentanément indisponible.