XEVUDY est administré, après dilution, en perfusion IV unique d'une durée de 30 minutes (illustration).
Résumé
La Haute Autorité de santé (HAS) a délivré une autorisation d'accès précoce à l'anticorps monoclonal XEVUDY 500 mg solution à diluer pour perfusion (sotrovimab).
Ce médicament a reçu une autorisation de mise sur le marché (AMM) européenne en décembre 2021, dans le traitement des adultes et adolescents (12 ans et plus, et pesant au moins 40 kg) infectés par le SARS-CoV-2, ne nécessitant pas de supplémentation en oxygène, mais présentant un risque d'évolution vers une forme sévère de la COVID-19.
La mise à disposition de XEVUDY en France permet de disposer d'un anticorps monoclonal dans le traitement curatif de la COVID, y compris en présence du variant Omicron. En effet, la combinaison d'anticorps disponible jusqu'à présent, le RONAPREVE (casirivimab + indevimab), n'a pas d'activité neutralisante vis-à-vis de ce variant et ne peut être utilisée en traitement curatif qu'en cas d'infection par le variant Delta.
L'efficacité de XEVUDY a été démontrée au cours de l'étude COMET-ICE, avec une réduction du risque de progression vers une forme sévère de la COVID-19 de l'ordre de 80 %.
En pratique, XEVUDY est un médicament réservé à l'usage hospitalier, selon la procédure des médicaments autorisés en accès précoce (conformément au protocole d'utilisation thérapeutique et de recueil de données).
La dose recommandée est une perfusion IV unique de 500 mg, administrée en 30 minutes, dans les 5 jours qui suivent l'apparition des symptômes de l'infection.
EDIT du 12 janvier 2022 : XEVUDY devrait être disponible en France d'ici fin janvier 2022 selon l'Agence nationale de sécurité du médicament et des produits de santé (ANSM). /FIN EDIT
EDIT du 24 janvier 2022 : la mise à disposition de XEVUDY est effective en France, comme le confirme un nouveau DGS-Urgent. /FIN EDIT
La Haute Autorité de santé (HAS) a délivré une autorisation d'accès précoce à l'anticorps monoclonal XEVUDY 500 mg solution à diluer pour perfusion (sotrovimab).
Ce médicament a reçu une autorisation de mise sur le marché (AMM) européenne en décembre 2021, dans le traitement des adultes et adolescents (12 ans et plus, et pesant au moins 40 kg) infectés par le SARS-CoV-2, ne nécessitant pas de supplémentation en oxygène, mais présentant un risque d'évolution vers une forme sévère de la COVID-19.
La mise à disposition de XEVUDY en France permet de disposer d'un anticorps monoclonal dans le traitement curatif de la COVID, y compris en présence du variant Omicron. En effet, la combinaison d'anticorps disponible jusqu'à présent, le RONAPREVE (casirivimab + indevimab), n'a pas d'activité neutralisante vis-à-vis de ce variant et ne peut être utilisée en traitement curatif qu'en cas d'infection par le variant Delta.
L'efficacité de XEVUDY a été démontrée au cours de l'étude COMET-ICE, avec une réduction du risque de progression vers une forme sévère de la COVID-19 de l'ordre de 80 %.
En pratique, XEVUDY est un médicament réservé à l'usage hospitalier, selon la procédure des médicaments autorisés en accès précoce (conformément au protocole d'utilisation thérapeutique et de recueil de données).
La dose recommandée est une perfusion IV unique de 500 mg, administrée en 30 minutes, dans les 5 jours qui suivent l'apparition des symptômes de l'infection.
EDIT du 12 janvier 2022 : XEVUDY devrait être disponible en France d'ici fin janvier 2022 selon l'Agence nationale de sécurité du médicament et des produits de santé (ANSM). /FIN EDIT
EDIT du 24 janvier 2022 : la mise à disposition de XEVUDY est effective en France, comme le confirme un nouveau DGS-Urgent. /FIN EDIT
Par décision du 6 janvier 2022, la Haute Autorité de santé (HAS) autorise l'accès précoce à l'anticorps monoclonal XEVUDY (sotrovimab), en tant que traitement curatif de la COVID-19, y compris les formes associées au variant Omicron du SARS-CoV-2 (cf. Encadré 1).
Encadré 1 - L'autorisation d'accès précoce en bref
L'accès précoce est une procédure permettant l'utilisation, à titre exceptionnel, d'un médicament dans une indication précise soit avant la délivrance d'une AMM, soit dans l'attente de sa prise en charge par l'Assurance maladie au titre de son AMM, dès lors que toutes les conditions suivantes sont remplies :
|
EDIT du 24 janvier 2022 : comme annoncé par l'Agence nationale de sécurité du médicament et des produits de santé (ANSM), XEVUDY est mis à disposition en France depuis le 24 janvier 2022, selon un message DGS-Urgent /FIN EDIT.
XEVUDY 500 mg solution à diluer pour perfusion intraveineuse (IV) est un médicament développé par le laboratoire GSK.
Il a obtenu une autorisation de mise sur le marché (AMM) européenne le 17 décembre 2021, dans l'indication suivante :
- traitement des adultes et adolescents (âgés de 12 ans et plus et pesant au moins 40 kg) atteints de la maladie à coronavirus 2019 (COVID-19) qui ne nécessitent pas de supplémentation en oxygène et qui présentent un risque accru d'évolution vers une forme sévère de la COVID-19 (cf. Encadré 2)
Encadré 2 - Patients à risque de COVID-19 sévère (définis par l'ANRS-Maladies Infectieuses Émergentes)
|
Un agrément aux collectivités à court terme ?
Le dispositif d'accès précoce permet la mise à disposition rapide de ce médicament, dans l'attente d'une autorisation de prise en charge pérenne (agrément aux collectivités).
L'autorisation d'accès précoce relative à XEVUDY est valable pour une durée de douze mois.
Dans son avis du 5 janvier 2022, la HAS indique que « le laboratoire s'est engagé à déposer une demande d'inscription sur la liste des spécialités agréées à l'usage des collectivités dans un délai maximum d'un mois après l'obtention de l'AMM », ce qui correspondrait à un demande d'inscription en janvier 2022.
En outre, la HAS est favorable à un accès des anticorps monoclonaux en ville.
Le sotrovimab, une activité neutralisante attendue vis-à-vis du variant Omicron
Le sotrovimab, principe actif de XEVUDY, est un nouvel anticorps monoclonal humain de type IgG1 qui se lie à un épitope hautement conservé du domaine de liaison au récepteur (RBD = Receptor Binding Domain) de la protéine de spicule du SARS-CoV-2.
En comparaison aux autres anticorps monoclonaux dirigés contre le SARS-CoV-2, le sotrovimab se distingue par sa double capacité d'action :
- action neutralisante : en empêchant le virus d'infecter de nouvelles cellules,
- action effectrice puissante : en éliminant les cellules déjà infectées.
XEVUDY : seul anticorps monoclonal utilisable en curatif contre Omicron
Dans le contexte actuel de prédominance du variant Omicron, et tandis que les autres anticorps monoclonaux spécifiques du SARS-CoV-2 n'ont pas d'activité neutralisante vis-à-vis de ce variant (cf. notre article du 6 janvier 2021), XEVUDY permet de satisfaire le besoin en traitement curatif de la COVID-19 chez les patients infectés par Omicron (cf. Tableau I).
Pour rappel, dans la stratégie thérapeutique en France, RONAPREVE (casirivimab + indevimab) peut également être utilisé en traitement curatif de la COVID-19, uniquement en cas d'infection par le variant Delta. En revanche, la combinaison bamlanivimab + etesevimab ne doit plus être utilisée.
Tableau I - Recommandations d'utilisation des anticorps monoclonaux disponibles en France à la date du 11 janvier 2022
(mise à jour du DGS-Urgent du 4 janvier 2022)
(mise à jour du DGS-Urgent du 4 janvier 2022)
| Anticorps monoclonaux bénéficiant d'un accès précoce | Prévention préexposition | Prévention postexposition | Traitement curatif à domicile | Traitement curatif en milieu hospitalier |
| EVUSHELD tixagevimab + cilgavimab |
OUI | NON | NON | NON |
| RONAPREVE casirivimab + indevimab |
NON (passage à EVUSHELD) |
OUI, uniquement si Delta |
OUI, uniquement si Delta |
OUI, uniquement si Delta |
| XEVUDY sotrovimab |
NON | NON | NON | OUI |
Des alternatives aux anticorps monoclonaux (antiviral, anti-inflammatoire antagoniste du récepteur de l'interleukine-1, anticorps inhibiteur de l'interleukine-6, dexaméthasone) sont également envisageables en traitement curatif (cf. notre article du 6 janvier 2022).
Efficacité de XEVUDY : les résultats de l'étude COMET-ICE en synthèse
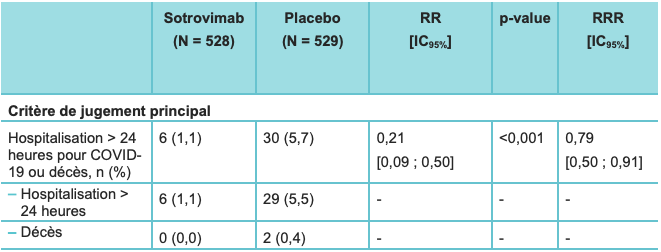
L'efficacité et la tolérance de XEVUDY ont été évaluées dans l'étude de phase II/III COMET-ICE, multicentrique, randomisée, en double aveugle, contrôlée versus placebo.
Le critère de jugement principal était la proportion de patients dont la maladie avait progressé vers une forme sévère au jour 29 :
- hospitalisation de plus de 24 heures pour une prise en charge aiguë de la maladie ;
- ou décès.
Tableau II - Résultats d'efficacité du sotrovimab (population ITT) - étude COMET-ICE
- l'absence de démonstration de l'impact du sotrovimab sur la négativation attendue de la charge virale ;
- l'absence de données cliniques sur le variant Delta et sur le variant Omicron bien que les données in vitro suggèrent une activité conservée du sotrovimab vis-à-vis des variants circulants préoccupants ;
- l'absence de données cliniques chez les sujets séropositifs ou vaccinés, ainsi que les sujets ayant une immunodépression sévère,
- l'utilisation en monothérapie et la longue demi-vie du sotrovimab pouvant faire craindre la sélection de variants résistants, surtout chez les patients ayant une excrétion virale prolongée (immunodéprimés).
Résistance au sotrovimab : un risque potentiel, à surveiller
La HAS recommande donc la mise en place d'une cohorte de suivi du sotrovimab, pour évaluer l'efficacité immunovirologique et clinique dans divers groupes de patients et suivre le risque d'émergence de résistances potentielles, notamment chez les patients immunodéprimés.
XEVUDY, en pratique
Demande d'accès au traitement et modalités de suivi
Les modalités d'accès à XEVUDY et de suivi des patients sont décrites dans le protocole d'utilisation thérapeutique et de recueil de données (PUT-RD).
Après réception de l'avis favorable d'accès au traitement du laboratoire, le prescripteur informe le médecin traitant du patient de la stratégie thérapeutique envisagée.
Il indique sur l'ordonnance la mention « prescription au titre d'une autorisation d'accès précoce ».
Le prescripteur et le pharmacien hospitalier participent au recueil des données collectées dans le cadre du PUT-RD. Ces données sont transmises au laboratoire GSK, selon des modalités assurant le respect du secret médical.
Schéma posologique : perfusion intraveineuse unique
Il est recommandé d'administrer XEVUDY dans les 5 jours suivant l'apparition des symptômes de la COVID-19.
XEVUDY doit être administré dans un établissement de santé.
XEVUDY se présente en flacon à usage unique de 10 mL, à conserver au réfrigérateur (entre 2 et 8 °C).
La dose recommandée est une perfusion IV unique de 500 mg de sotrovimab. La solution doit être diluée avant administration, conformément aux instructions décrites dans le résumé des caractéristiques du produit (RCP de XEVUDY).
Il est recommandé d'administrer la solution, une fois diluée, en 30 minutes avec un filtre en ligne de 0,2 µm. XEVUDY ne doit pas être administré par injection IV rapide ou par injection en bolus.
Le patient doit être surveillé durant l'administration et pendant au moins 1 heure après l'administration.
Données administratives de XEVUDY (selon le PUT-RD)
- Médicament réservé à l'usage hospitalier
- Boîte de 1 flacon de 8 mL de solution (contenance 10 mL), CIP 3400955086451
- Laboratoire GSK
Pour aller plus loin
COVID-19 : accès précoce accordé au Xevudy en traitement curatif (HAS, 7 janvier 2022)
Décision n° 2022.0001/DC/SEM du 6 janvier 2022 du collège de la Haute Autorité de santé portant autorisation d'accès précoce de la spécialité XEVUDY (HAS, 6 janvier 2022)
Avis sur XEVUDY : demande d'autorisation d'accès précoce pour une indication disposant d'une AMM (HAS, 5 janvier 2022)
Protocole d'utilisation thérapeutique et de recueil de données (PUT-RD) pour XEVUDY (HAS, janvier 2021)
EPAR XEVUDY (EMA, décembre 2021, mise à jour du 7 janvier 2022)
EDIT du 12 janvier 2022 :
Traitement curatif contre le Covid-19 : un nouvel anticorps monoclonal dans l'arsenal thérapeutique (ANSM, 11 janvier 2022)
/FIN EDIT
EDIT du 24 janvier 2022 :
Mise à disposition de l'anticorps monoclonal du laboratoire GSK : XEVUDY (DGS-Urgent n°2022_13, 24 janvier 2022)
/FIN EDIT
Pour recevoir gratuitement toute l’actualité par mail Je m'abonne !

 7 minutes
7 minutes Ajouter un commentaire
Ajouter un commentaire






Les commentaires sont momentanément désactivés
La publication de commentaires est momentanément indisponible.