L'hémophilie A résulte d'une mutation du gène F8 du locus q28 du chromosome X codant le facteur VIII de coagulation (illustration).
Résumé :
Disponible sur le marché hospitalier depuis 2019, l'anticorps monoclonal bispécifique HEMLIBRA solution injectable (émicizumab) peut, depuis le 15 juin 2021, être dispensé en officine, avec une prise en charge à 100 % par l'Assurance maladie.
HEMLIBRA est indiqué en prophylaxie pour prévenir les épisodes hémorragiques chez les patients atteints d'hémophilie A congénitale avec ou sans inhibiteurs anti-facteur VIII. Il peut être utilisé dans toutes les tranches d'âge.
Le principe actif d'HEMLIBRA, l'émicizumab, est un anticorps monoclonal humanisé bispécifique mimant l'activité du facteur VIII.
HEMLIBRA est présenté en solution injectable prête à l'emploi :
HEMLIBRA s'administre en injections sous-cutanées (SC) hebdomadaires.
La posologie recommandée est de :
La prescription d'HEMLIBRA est hospitalière. La base de remboursement s'échelonne de 2 495,38 euros TTC pour le flacon de 1 mL d'HEMLIBRA 30 mg/mL à 11 945,34 euros pour le flacon de 1 mL d'HEMLIBRA 150 mg/mL.
La mise à disposition d'HEMLIBRA en ville s'accompagne de mesure additionnelles de réduction des risques, reposant notamment sur une coordination entre le médecin prescripteur au sein du Centre de Références et de Compétences Maladies Hémorragiques Constitutionnelles (CRC-MHC), le pharmacien hospitalier et le pharmacien d'officine.
Disponible sur le marché hospitalier depuis 2019, l'anticorps monoclonal bispécifique HEMLIBRA solution injectable (émicizumab) peut, depuis le 15 juin 2021, être dispensé en officine, avec une prise en charge à 100 % par l'Assurance maladie.
HEMLIBRA est indiqué en prophylaxie pour prévenir les épisodes hémorragiques chez les patients atteints d'hémophilie A congénitale avec ou sans inhibiteurs anti-facteur VIII. Il peut être utilisé dans toutes les tranches d'âge.
Le principe actif d'HEMLIBRA, l'émicizumab, est un anticorps monoclonal humanisé bispécifique mimant l'activité du facteur VIII.
HEMLIBRA est présenté en solution injectable prête à l'emploi :
- à 30 mg/mL (flacon de 1 mL),
- à 150 mg/mL (flacons de 0,4 mL, 0,7 mL et 1 mL).
HEMLIBRA s'administre en injections sous-cutanées (SC) hebdomadaires.
La posologie recommandée est de :
- 3 mg/kg 1 fois par semaine au cours des 4 premières semaines (dose de charge),
- puis 1,5 mg/kg 1 fois par semaine, ou 3 mg/kg toutes les 2 semaines, ou 6 mg/kg toutes les 4 semaines (doses d'entretien).
La prescription d'HEMLIBRA est hospitalière. La base de remboursement s'échelonne de 2 495,38 euros TTC pour le flacon de 1 mL d'HEMLIBRA 30 mg/mL à 11 945,34 euros pour le flacon de 1 mL d'HEMLIBRA 150 mg/mL.
La mise à disposition d'HEMLIBRA en ville s'accompagne de mesure additionnelles de réduction des risques, reposant notamment sur une coordination entre le médecin prescripteur au sein du Centre de Références et de Compétences Maladies Hémorragiques Constitutionnelles (CRC-MHC), le pharmacien hospitalier et le pharmacien d'officine.
Depuis le 15 juin 2021, l'anticorps monoclonal humanisé bispécifique HEMLIBRA solution injectable (émicizumab) est remboursable à 100 % dans le cadre d'une dispensation en pharmacie de ville.
HEMLIBRA est indiqué en prophylaxie pour prévenir les épisodes hémorragiques :
- chez les patients atteints d'hémophilie A (déficit congénital en facteur VIII) avec inhibiteurs anti-facteur VIII (cf. VIDAL Reco "Hémophilie") ;
- chez les patients atteints d'hémophilie A sévère (déficit congénital en facteur VIII, FVIII < 1 %) sans inhibiteur anti-facteur VIII.
HEMLIBRA est commercialisé en France depuis 2019. Jusqu'à présent, il était exclusivement distribué à l'hôpital (cf. notre article du 2 avril 2019).
Malgré la mise à disposition en ville, les modalités de prescription d'HEMLIBRA sont inchangées : la prescription reste hospitalière.
Le traitement doit être instauré sous la surveillance d'un médecin expérimenté dans la prise en charge de l'hémophilie et/ou des troubles de l'hémostase.
 HEMLIBRA fait l'objet d'une surveillance supplémentaire qui permettra l'identification rapide de nouvelles informations relatives à la sécurité. Les professionnels de la santé déclarent tout effet indésirable suspecté.
HEMLIBRA fait l'objet d'une surveillance supplémentaire qui permettra l'identification rapide de nouvelles informations relatives à la sécurité. Les professionnels de la santé déclarent tout effet indésirable suspecté.Un dispositif pour sécuriser la mise à disposition d'HEMLIBRA en ville
HEMLIBRA bénéficie du double circuit de dispensation ville/pharmacie à usage interne (PUI).
La mise à disposition d'HEMLIBRA en ville s'accompagne de mesures additionnelles de réductions des risques (MARR), qui prévoient :
- une initiation du traitement par HEMLIBRA en centre spécialisé ;
- une poursuite du traitement en ville, si le patient souhaite bénéficier d'une dispensation en ville. Dans ce cas, le centre spécialisé transmet les coordonnées du pharmacien d'officine choisi au pharmacien hospitalier ou à un membre de l'équipe du Centre de Références et de Compétences Maladies Hémorragiques Constitutionnelles (CRC-MHC).
Ce circuit coordonné permet au pharmacien d'officine :
- de disposer d'un accès au module de formation sur la pathologie, l'environnement et les traitements mis à disposition par le Centre de Référence Hémophilie et autres déficits constitutionnels des protéines de la coagulation (https://hemoweb.fr/hemophar/) ;
- de recevoir la prescription du médecin du CRC-MHC où est traité le patient et des informations nécessaires à sa bonne prise en charge telles que les coordonnées des différents intervenants ;
- d'anticiper la commande du traitement pour la prochaine dispensation.
Le pharmacien d'officine conserve pour chaque patient, une copie de l'ordonnance, des délivrances successives et les éventuelles informations associées.
Pour accompagner la dispensation auprès des patients, les pharmaciens peuvent également s'appuyer sur le Guide pratique d'utilisation d'HEMLIBRA destiné aux patients et aux aidants (Roche, janvier 2021).
À propos de l'anticorps monoclonal émicizimab
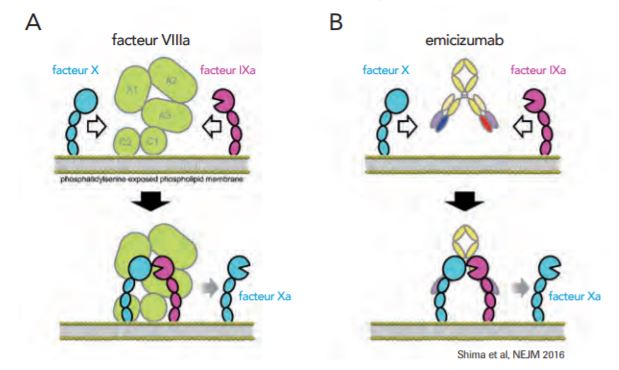
L'émicizumab est un anticorps monoclonal mimant l'activité du facteur VIII (FVIII). Ce mécanisme d'action repose sur sa capacité à se lier au facteur IXa et au facteur X pour restaurer la fonction du facteur VIIIa nécessaire à une hémostase efficace, d'où le terme d'anticorps monoclonal bispécifique (cf. Figure 1).
Figure 1 - Mécanisme d'action de l'émicizumab
(figure extraite du Guide destiné aux professionnels de santé)
Un SMR important et une ASMR de niveau II(figure extraite du Guide destiné aux professionnels de santé)
 |
Dans son avis du 4 décembre 2019, la Commission de la Transparence (CT) s'est prononcée en faveur du remboursement en ville d'HEMLIBRA.
Les conclusions de cette dernière évaluation médico-économique n'ont pas été modifiées par rapport aux avis précédents (cf. notre article du 2 avril 2019) :
- un service médical rendu (SMR) important ;
- une amélioration du service médical rendu (ASMR) de niveau II (important).
Cette ASMR exceptionnelle est justifiée par :
- un besoin médical très partiellement couvert pour la prise en charge des patients atteints d'hémophilie A congénitale avec inhibiteurs forts répondeurs,
- des études cliniques de phase III menées exclusivement chez des patients ayant développé un inhibiteur de type fort répondeur, pour la plupart atteints d'une forme sévère d'hémophilie,
- des données démontrant l'efficacité d'HEMLIBRA pour prévenir les saignements dans cette population, en particulier chez l'enfant,
- des données suggérant une efficacité supérieure à celle d'une prophylaxie par agents bypassants (FEIBA et NOVOSEVEN),
- du bénéfice important attendu sur la qualité de vie par rapport aux alternatives disponibles,
- et malgré les incertitudes relatives à son utilisation au long cours et en pratique courante (impact de l'interaction médicamenteuse avec FEIBA sur le pronostic des patients pris en charge pour un saignement grave intercurrent, gestion des interventions chirurgicales, utilisation chez les patients les plus âgés, coronariens ou saignant peu, risque d'anticorps inhibiteurs anti-emicizumab, interférence avec certains tests de coagulation).
HEMLIBRA en pratique : 1 dose de charge et 3 schémas de dose d'entretien au choix
HEMLIBRA est administré par voie sous-cutanée (SC).
La posologie recommandée (cf. Encadrés 1 et 2) est :
- en dose de charge (4 premières semaines) : de 3 mg/kg 1 fois par semaine ;
- en dose d'entretien :
- soit de 1,5 mg/kg 1 fois par semaine,
- soit de 3 mg/kg toutes les 2 semaines,
- soit de 6 mg/kg toutes les 4 semaines.
La dose de charge est la même, quel que soit le schéma posologique choisi pour la dose d'entretien.
Outre les critères médicaux, le choix du schéma de dose d'entretien tient compte du critère d'observance.
Encadré 1 - Calcul de la dose (mg) d'HEMLIBRA
Dose de charge (3 mg/kg) 1 fois par semaine pendant les 4 premières semaines :
|
Encadré 2 - Calcul du volume (mL) d'HEMLIBRA
| Quantité totale (mg) d'émicizumab à administrer ÷ concentration du flacon (mg/mL) = volume total d'HEMLIBRA (mL) à injecter. Le volume injecté ne doit pas être supérieur à 2 mL par injection. |
HEMLIBRA et autres traitements associés à l'hémophilie
Le traitement (incluant la prophylaxie) par des agents by-passants doit être interrompu la veille de l'instauration du traitement par HEMLIBRA.
La prophylaxie par facteur VIII (FVIII) peut être poursuivie durant les 7 premiers jours de traitement par HEMLIBRA.
Préparation d'HEMLIBRA après le calcul du volume
La solution d'HEMLIBRA est prête à l'emploi. Les flacons sont à usage unique.
Deux dosages d'HEMLIBRA sont proposés :
- 30 mg/mL (flacon de 1 mL),
- 150 mg/mL (flacons de 0,4 mL, 0,7 mL et 1 mL).
Modalités d'administration d'HEMLIBRA
Les sites d'injection SC recommandés sont l'abdomen, les parties supérieures externes des bras (par une tierce personne) et les cuisses.
Les consignes suivantes doivent être rappelées à la personne qui injecte HEMLIBRA :
- alterner le site d'injection ;
- ne pas injecter dans les zones où la peau est rouge, contusionnée, sensible ou indurée, ni dans les régions qui présentent des nævi ou des cicatrices ;
- administrer les autres médicaments injectables SC au niveau de sites anatomiques différents.
Après accord du prescripteur et formation appropriée à la technique d'injection SC, le patient pourra s'auto-injecter HEMLIBRA. L'auto-injection n'est pas recommandée pour les enfants âgés de moins de 7 ans.
L'aidant peut injecter HEMLIBRA, après avoir reçu une formation appropriée.
Matériel d'injection : à prescrire en supplément
Le matériel d'injection à utiliser avec HELIMBRA (pour le prélèvement et l'injection) comprend 1 seringue, 1 aiguille de transfert (ou un adaptateur pour flacon) et 1 aiguille d'injection.
Ce matériel n'est pas fourni avec le flacon d'HEMLIBRA ; il doit être prescrit/délivré en complément :
- seringue (polypropylène ou polycarbonate, embout Luer-lock, graduation de 0,01 mL) de 1 mL pour un volume maximal d'injection et de 1 mL ;
- seringue de 2 à 3 mL (polypropylène ou polycarbonate, embout Luer-lock, graduation de 0,1 mL) pour un volume supérieur à 1 mL et jusqu'à 2 mL ;
- aiguille de transfert avec filtre : aiguille en acier inoxydable et munie d'une connexion Luer-lock (calibre 18 G, longueur de 35 mm (½"), filtre de 5 µm, et de préférence à extrémité semi-émoussée ;
- aiguille d'injection : en acier inoxydable munie d'une connexion Luer-lock, de calibre 26 G (intervalle acceptable : 25-27 gauge), d'une longueur de préférence de 9 mm (3/8") ou maximale de 13 mm (½") comprenant de préférence un dispositif de sécurité.
Consignes de conservation et de traçabilité
Afin d'améliorer la traçabilité des médicaments biologiques, le nom de la spécialité et le numéro de lot du produit administré doivent être clairement inscrits dans le dossier du patient.
HEMLIBRA doit être conservé au réfrigérateur entre 2 et 8 °C.
Une fois sortis du réfrigérateur, les flacons non ouverts peuvent être conservés à température ambiante (température < 30 °C) pendant une durée maximale de 7 jours. Si ce délai n'est pas dépassé, les flacons non ouverts peuvent être remis au réfrigérateur.
Identité administrative
- Liste I
- Prescription hospitalière
- HEMLIBRA 30 mg/mL, flacon de 1 mL de solution injectable, CIP 3400930141410, UCD 3400894365785, prix public TTC = 2 495,38 euros
- HEMLIBRA 150 mg/mL :
- flacon de 0,4 mL de solution injectable, CIP 3400930141427, UCD 3400894365846, prix public TTC = 4 857,87 euros
- flacon de 0,7 mL de solution injectable, CIP 3400930141434, UCD 3400894365556, prix public = 8 401,61 euros
- flacon 1 mL de solution injectable, CIP 3400930141441, UCD 3400894365617, prix public = 11 945,34 euros
- Remboursable à 100 % (Journal officiel du 26 mai 2021 - texte 13 - cf. Encadré 3)
- Agrément aux collectivités (Journal officiel du 6 février 2019 - texte 4 et Journal officiel du 18 mars 2020 - texte 14)
- Inscription sur la liste de rétrocession avec taux de prise en charge à 100 % (Journal officiel du 6 février 2019 - texte 5 et Journal officiel du 18 mars 2020 - texte 13)
- Laboratoire Roche
Encadré 3 - Périmètre de prise en charge d'HEMLIBRA (remboursement en ville, agrément aux collectivités et rétrocession)
En prophylaxie pour prévenir les épisodes hémorragiques (dans toutes les tranches d'âge) :
|
Pour aller plus loin
Avis de la Commission de la Transparence - HEMLIBRA (HAS, 11 juillet 2018)
Avis de la Commission de la Transparence - Passage en ville (HAS, 4 décembre 2019)
Dispensation en officine des spécialités HEMLIBRA à compter du 15 juin 2021 (Ordre des pharmaciens, 18 juin 2021)
Documents pour accompagner la prescription/délivrance/administration d'HEMLIBRA :
Guide destiné aux patients et aux soignants (laboratoire Roche - janvier 2021)
Sur VIDAL.fr
HÉMOPHILIE A : HEMLIBRA SOLUTION INJECTABLE, PREMIER ANTICORPS MONOCLONAL BISPÉCIFIQUE EN INJECTION SC HEBDOMADAIRE (EDIT DU 24 MARS 2020) (2 avril 2019)
Pour aller plus loin
Consultez les monographies VIDAL
Consultez les VIDAL Recos
Sources
Pour recevoir gratuitement toute l’actualité par mail Je m'abonne !

 8 minutes
8 minutes Ajouter un commentaire
Ajouter un commentaire





Commentaires
Cliquez ici pour revenir à l'accueil.