Après reconstitution et dilution, FETCROJA doit être administré en perfusion intraveineuse de 3 heures (illustration).
Une nouvelle spécialité antibiotique, FETCROJA 1 g poudre pour solution à diluer pour perfusion (céfidérocol sulfate tosilate), est désormais disponible à l'hôpital, dans le traitement des infections dues à des bactéries aérobies à Gram négatif chez des patients adultes pour qui les options thérapeutiques sont limitées.
Il convient de tenir compte des recommandations officielles concernant l'utilisation appropriée des antibactériens.
En France, FETCROJA a bénéficié d'une autorisation temporaire d'utilisation nominative (ATUn), puis d'une ATU de cohorte (ATUc), entre 2018 et fin 2020, ayant inclus respectivement 21 et 14 patients.
FETCROJA fait l'objet d'une surveillance supplémentaire qui permettra l'identification rapide de nouvelles informations relatives à la sécurité. Les professionnels de santé déclarent tout effet indésirable suspecté.
Le céfidérocol : une céphalosporine sidérophore
Le principe actif de FETCROJA est un nouvel antibiotique de la classe des céphalosporines, le céfidérocol, conjugué à un groupement sidérophore, l'ensemble étant plus couramment appelée céphalosporine sidérophore.
Le groupement sidérophore présente deux intérêts majeurs :
- faciliter la liaison du céfidérocol au fer libre extracellulaire, ce qui permet une pénétration dans la bactérie à Gram négatif (transport actif dans l'espace péri-plasmique des bactéries à Gram négatif). Le céfidérocol se lie ensuite aux protéines de liaison aux pénicillines (PLPs), ce qui inhibe la synthèse du peptidoglycane de la paroi cellulaire bactérienne et entraîne la lyse et la mort de la bactérie ;
- protéger la molécule de l'activité hydrolytique de la plupart des ß-lactamases, y compris celles appartenant à la classe B d'Ambler.
Le céfidérocol n'est pas actif contre les bactéries aérobies à Gram positif et les bactéries anaérobies.
Céfidérocol : non infériorité démontrée dans un contexte d'infections respiratoires ou urologiques à Gram négatif
Le céfidérocol présente une activité in vitro sur une large variété de bactéries à Gram négatif, telles que les entérobactéries et Pseudomonas aeruginosa résistantes aux carbapénèmes, avec un mécanisme de résistance de type KPC, oxacillinase ou métallo-ß-lactamases [NDM, VIM, IMP] ou de bactéries non fermentaires telles que Acinetobacter baumannii ou Stenotrophomonas maltophilia.
Dans son avis du 20 janvier 2021, la Commission de la Transparence (CT) a évalué FETCROJA sur la base principalement de trois études conduites dans 2 domaines thérapeutiques distincts, l'urologie et la pneumologie :
- étude de phase II APEKS-cUTI conduite dans les infections des voies urinaires compliquées par des bactéries à Gram négatif (n = 452). Dans cette étude de non-infériorité, multicentrique, contrôlée, randomisée, en double aveugle, en groupes parallèles, comparative versus imipénème/cilastatine (TIENAM), la réponse au traitement était définie par la proportion de patients ayant une éradication microbienne (< 104 UFC/mL) accompagnée d'une guérison ou d'une amélioration clinique à 7 +/- 2 jours après l'arrêt du traitement. Selon les résultats de cette étude, la non-infériorité du céfidérocol par rapport à l'association imipénème/cilastatine a été démontrée chez des patients adultes hospitalisés atteints d'infections des voies urinaires compliquées, causées par une bactérie Gram négatif, en termes de réponse clinique et microbiologique lors de l'évaluation de la réponse au traitement : 72,6 % (183/252) versus 54,6 % (65/119), soit une différence ajustée entre les deux groupes de 18,58 % (IC95 % = [8,23 ; 28,92]) ;
- étude de phase III APEKS-NP (n = 300), conduite chez des patients atteints de pneumonie nosocomiale (PN), pneumonie acquise sous ventilation mécanique (PAVM) ou pneumonie associée aux soins (PAS) causée par des bactéries à Gram négatif. Selon les résultats de cette étude de non-infériorité, multicentrique, contrôlée, randomisée, en double aveugle, en groupes parallèles, comparative versus méropénème à forte dose, la non-infériorité du céfidérocol a été démontrée par rapport au méropénème, en termes de mortalité toutes causes confondues à J14 dans la population ITTm* : 12,4 % (18/145) versus 11,6 % (17/146), soit une différence ajustée de 0,8 % (IC95 % = [-6,6 ; 8,2]) ;
- étude de phase III CREDIBLE-CR (n = 118) conduite dans les infections sévères causées par des bactéries Gram négatif (PN, PAVM, PAS, bactériémie/sepsis et infections des voies urinaires compliquées). Cette étude descriptive, multicentrique, contrôlée, randomisée, en ouvert, en groupes parallèles, avait pour objectif d'évaluer l'efficacité et la tolérance du céfidérocol administré à la dose de 2 g toutes les 8 heures par perfusion IV de 3 heures pendant 7 à 14 jours par rapport à la meilleure thérapie disponible (MTD) chez des patients adultes atteints d'infections bactériennes à Gram négatif documentées et résistantes aux carbapénèmes. Les résultats de cette étude suggèrent une réponse favorable en termes de guérison clinique et d'éradication microbiologique chez des patients atteints d'infections résistantes aux carbapénèmes, notamment ceux avec un mécanisme de résistance de type métallo-lactamases pour lesquelles peu ou pas d'alternatives sont disponibles. Ils font par ailleurs état d'un surcroît de mortalité, inexpliqué à ce jour, en particulier en cas pneumopathie ou de bactériémie/sepsis dues à Acinetobacter baumannii, et de données limitées en cas d'infection à Stenotrophomonas maltophilia.
* en intention de traiter modifiée
SMR important à 2 conditions majeures
À l'issue de cette évaluation et sur la base des données disponibles, la CT a attribué à FETCROJA un service médical rendu (SMR) important et une amélioration du SMR mineure (ASMR IV) dans l'indication de l'AMM uniquement :
- en dernier recours pour le traitement des patients atteints d'infections à bactéries à Gram négatif multirésistantes (notamment en cas d'entérobactéries et Pseudomonas aeruginosa, avec un mécanisme de résistance de type KPC, oxacillinase ou métallo-ß-lactamases [NDM, VIM, IMP]),
- et lorsque le recours aux autres options disponibles n'est pas envisageable.
Dans les autres situations, la CT a émis un avis défavorable au remboursement.
La CT considère que la place du céfidérocol dans la stratégie thérapeutique est celle d'un antibiotique de dernier recours (c'est-à-dire lorsque les options disponibles ne sont pas envisageables), réservé aux patients atteints d'infections à bactéries à Gram négatif multirésistantes :
- notamment en cas d'entérobactéries et Pseudomonas aeruginosa, avec un mécanisme de résistance de type KPC, oxacillinase ou métallo-ß-lactamases (NDM, VIM, IMP),
- à l'exception d'Acinetobacter baumannii et Stenotrophomonas maltophilia, faute de données suffisantes.
FETCROJA ne doit pas être utilisé comme alternative aux carbapénèmes pour le traitement des entérobactéries résistantes aux céphalosporines de troisième génération et pour le traitement des infections à Pseudomonas aeruginosa sensibles aux carbapénèmes.
FETCROJA en pratique
FETCROJA est recommandé pour le traitement :
- des patients adultes pour qui les options thérapeutiques sont limitées,
- uniquement après avis d'un médecin expérimenté dans la prise en charge des maladies infectieuses. La décision d'instauration du traitement par FETCROJA doit être prise après proposition documentée issue d'une réunion de concertation thérapeutique avec un référent antibiotique, avec réévaluation systématique 48 heures après le début du traitement.
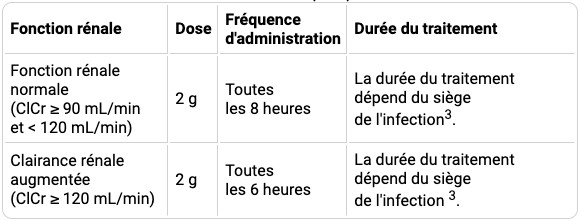
Une dose à définir en tenant compte de la fonction rénale
La dose de céfidérocol dépend de la fonction rénale. Celle-ci doit être contrôlée régulièrement en cours de traitement, afin d'ajuster la dose si nécessaire.
Les posologies recommandées chez les patients en fonction de la clairance de la créatinine sont résumées dans les tableaux I et II ci-après (extrait de la monographie VIDAL de FETCROJA - Rubrique Posologie et Mode d'administration).
2 Calculée selon la formule de Cockcroft-Gault.
3 Par exemple, en cas d'infections urinaires compliquées, y compris les pyélonéphrites, et d'infections intra-abdominales compliquées, la durée de traitement recommandée est de 5 à 10 jours. En cas de pneumonies nosocomiales, y compris de pneumonies acquises sous ventilation mécanique, la durée de traitement recommandée est de 7 à 14 jours. Une durée de traitement allant jusqu'à 21 jours peut être nécessaire.
Tableau II - Posologie de FETCROJA recommandée chez les patients ayant une ClCr < 90 mL/min1
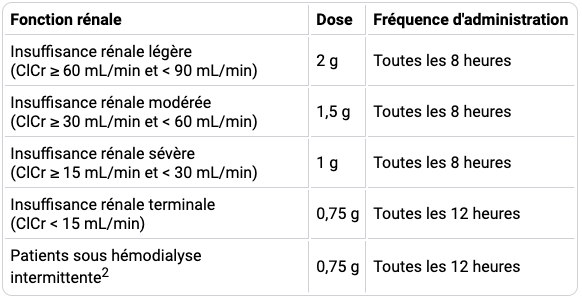
2 Le céfidérocol étant éliminé par l'hémodialyse, il doit être administré le plus tôt possible après la fin de la séance les jours d'hémodialyse.
FETCROJA doit être utilisé en association avec des antibiotiques actifs sur les bactéries anaérobies et/ou sur les bactéries à Gram positif si elles sont connues ou suspectées d'être impliquées dans l'infection.
Antibiotique en perfusion intraveineuse
FETCROJA est administré en perfusion intraveineuse de 3 heures.
Avant l'administration, deux étapes sont nécessaires :
- reconstitution de la poudre avec du chlorure de sodium 0,9 % ou du glucose 5 % (10 mL) ;
- dilution de la dose nécessaire (dans du chlorure de sodium 0,9 % ou du glucose 5 %), prélevée à partir de la solution reconstituée.
Chaque flacon de FETCROJA est à usage unique.
Avant utilisation, le flacon de FETCROJA est à conserver au réfrigérateur entre 2 et 8 °C, dans la boîte d'origine à l'abri de la lumière.
Identité administrative
- Liste I
- Réservé à l'usage hospitalier
- Boîte de 10 flacons de 14 mL, CIP 3400955075493
- Prise en charge en relais de l'ATU de cohorte (article L.162-16-5-2 du Code de la Sécurité sociale).
- Non agréé aux collectivités à la date du 1er avril 2021 (demande d'admission à l'étude).
- Laboratoire Shionogi SAS depuis 2022
EDIT du 21 juillet 2021 : FETCROJA a obtenu l'agrément aux collectivités le 20 juillet 2021 (arrêté du 12 juillet 2021 - Journal officiel du 20 juillet 2021, texte 29), uniquement en dernier recours pour le traitement des patients atteints d'infections à bactéries à Gram négatif multirésistantes (notamment en cas d'entérobactéries et Pseudomonas aeruginosa, avec un mécanisme de résistance de type KPC, oxacillinase ou métallo-?-lactamases [NDM, VIM, IMP]) et lorsque le recours aux autres options disponibles n'est pas envisageable.
La décision d'instauration du traitement par FETCROJA devra être prise après proposition documentée issue d'une réunion de concertation thérapeutique avec un référent antibiotique, avec réévaluation systématique 48 heures après le début du traitement. /FIN EDIT.
Pour aller plus loin
Avis de la Commission de la Transparence - FETCROJA (HAS, 20 janvier 2021)
Les études pivots :
- étude APEKS-cUTI : Simon Portsmouth, et al. Cefiderocol versus imipenem-cilastatin for the treatment of complicated urinary tract infections caused by Gram-negative uropathogens: a phase 2, randomised, double-blind, non-inferiority trial. Published Online October 25, 2018
- étude APEKS-NP : Wunderink RG, Wunderink RG, Matsunaga Y, et al. LB4. Efficacy and Safety of Cefiderocol vs. High-Dose Meropenem in Patients with Nosocomial Pneumonia—Results of a Phase 3, Randomized, Multicenter, Double-Blind, Non-Inferiority Study. Open Forum Infect Dis. 2019 ; 6(Suppl 2) : S994. Published 2019 Oct 23
- étude CREDIBLE-CR : Bassetti M, el al. Efficacy and safety of cefiderocol or best available therapy for the treatment of serious infections caused, by carbapenem-resistant Gram-negative bacteria (CREDIBLE-CR): a randomised, open-label, multicentre, pathogen- focused, descriptive, phase 3 trial. Lancet Infect Dis 2021 Feb ; 21(2) : 226-240

 10 minutes
10 minutes Ajouter un commentaire
Ajouter un commentaire





Commentaires
Cliquez ici pour revenir à l'accueil.