
La migraine est une maladie douloureuse et invalidante qui peut se traduire par un handicap et une dégradation marquée de la qualité de vie (illustration).
L'arsenal thérapeutique de la migraine compte une nouvelle spécialité, EMGALITY 120 mg solution injectable en stylo prérempli (galcanézumab), indiquée dans la prophylaxie de la migraine chez l'adulte ayant au moins 4 jours de migraine par mois (cf. VIDAL Reco "Migraine").
Selon les informations communiquées par le laboratoire Lilly (22 mars 2021), ce médicament est actuellement disponible en ville, en commande directe auprès du laboratoire. Il est également distribué à l'hôpital.
EMGALITY fait l'objet d'une surveillance supplémentaire qui permettra l'identification rapide de nouvelles informations relatives à la sécurité. Les professionnels de santé déclarent tout effet indésirable suspecté.
Un anticorps monoclonal en prophylaxie de la migraine
Principe actif d'EMGALITY, le galcanézumab est un anticorps monoclonal IgG4 humanisé qui se lie au peptide relié au gène de la calcitonine (CGRP), une substance impliquée dans la migraine.
Le CGRP élargit les vaisseaux sanguins dans le cerveau.
En bloquant le CGRP, le galcanézumab empêche ainsi son activité biologique.
Efficacité du galcanézumab sur la migraine épisodique et sur la migraine chronique
EMGALITY a obtenu une AMM (autorisation de mise sur le marché) sur la base de plusieurs études de supériorité versus placebo, ayant permis de démontrer l'efficacité du galcanézumab (soit à 120 mg/mois avec dose de charge de 240 mg, ou 240 mg/mois) sur différents profils cliniques de migraine :
- migraine épisodique (4 à 14 jours de migraine et au moins 2 crises de migraine par mois en moyenne depuis 3 mois) : deux études de supériorité multicentriques, contrôlées, randomisées en double aveugle en groupes parallèles, comparative versus placebo, EVOLVE-1 [1] (n = 858) et EVOLVE-2 [2] (n = 915), de méthodologie similaire. Le galcanézumab a été supérieur au placebo, avec une quantité d'effet modérée, sur la variation du nombre de jours de migraine par mois (JMM) entre l'inclusion et à 6 mois de traitement de la période en double aveugle : -1,9 à -2,0 jours chez des patients ayant 9 jours de migraine par mois à l'inclusion ;
- migraine chronique (15 jours ou plus de céphalées par mois pendant plus de 3 mois, avec au moins 8 jours de migraine) : étude REGAIN [3] (n = 1113). La supériorité du galcanézumab par rapport au placebo a été démontrée, avec une quantité d'effet modérée, la différence moyenne du nombre de JMM entre l'inclusion et à 3 mois de traitement ayant été de -2,1 jours (IC95 % [-2,9 ; -1,3], p < 0,001) à la dose validée par l'AMM (120 mg) ;
- migraine épisodique et migraine chronique, spécifiquement chez des patients en échec de 2 à 4 traitements prophylactiques : étude CONQUER (non publiée). La supériorité du galcanézumab 120 mg par rapport au placebo a été démontrée, avec une quantité d'effet modéré sur le critère de jugement principal, à savoir une différence moyenne du nombre de JMM de - 3,1 (IC95 % [-3,9 ; -2,3], p < 0,001) entre l'inclusion et les 3 mois de traitement dans la population ITT.
En termes de tolérance, les données disponibles sont à court terme (suivi maximal de 1 an) et des incertitudes persistent sur le long terme, s'agissant notamment des risques cardiovasculaires (aucune donnée de sécurité disponible) et d'immunogénicité (risque de développement d'anticorps anti-galcanézumab).
SMR important dans un périmètre bien défini
EMGALITY a fait l'objet d'une évaluation médico-économique par la Commission de la Transparence (CT), en vue de son remboursement en ville et agrément aux collectivités (avis du 24 juin 2020).
Selon ses conclusions, basées sur les résultats des études de supériorité comparant le galcanézumab au placebo, la CT a attribué à EMGALITY un service médical rendu (SMR) important chez les patients atteints de migraine sévère :
- avec au moins 8 jours de migraine par mois,
- en échec à au moins deux traitements prophylactiques,
- et sans atteinte cardiovasculaire (patients ayant eu un infarctus du myocarde, angor instable, pontage coronarien, intervention coronarienne percutanée, accident vasculaire cérébral, thrombose veineuse profonde ou à autre risque cardiovasculaire grave).
Ces critères constituent le cadre de prise en charge recommandé. La CT ne recommande pas de prise en charge dans les autres situations, où elle estime que le SMR est insuffisant.
La CT considère par ailleurs qu'EMGALITY n'apporte pas d'amélioration du SMR (ASMR V).
À la date du 25 mars 2021, EMGALITY est officiellement pris en charge dans le cadre de l'agrément aux collectivités. En revanche, bien que la HAS recommande un remboursement en ville au taux de 65 % dans une population de patients migraineux définie, EMGALITY n'est pas remboursable à ce jour.
EMGALITY en pratique
Le traitement doit être instauré par des médecins expérimentés dans le diagnostic et le traitement de la migraine. En France, la prescription d'EMGALITY est réservée aux neurologues.
Injection sous-cutanée mensuelle
Le schéma posologique comprend 1 injection sous-cutanée (SC) mensuelle de 120 mg de galcanézumab, avec une dose de charge de 240 mg à l'initiation.
Les sites d'injection SC recommandés sont l'abdomen, la cuisse, l'arrière du bras ou dans le fessier.
L'injection peut être réalisée par le patient lui-même, sous réserve d'une formation à l'utilisation du stylo prérempli, et de l'accord du médecin prescripteur.
Consignes d'utilisation du stylo prérempli
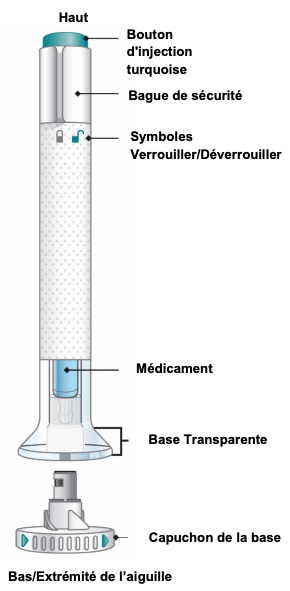 Le stylo prérempli EMGALITY permet d'injecter une dose unique de 120 mg.
Le stylo prérempli EMGALITY permet d'injecter une dose unique de 120 mg.Il est prêt à l'emploi et muni d'une aiguille protégée par un capuchon amovible.
Le stylo comporte un système de verrouillage/déverrouillage.
L'injection est déclenchée en appuyant sur le bouton poussoir de couleur turquoise.
Les consignes de sécurité habituelles sont à rappeler aux patients :
- inspection visuelle de la solution avant toute administration ;
- ne pas utiliser EMGALITY si la solution est trouble, présente une coloration anormale ou contient des particules, ou si une partie du stylo semble endommagée.
Le stylo ne doit pas être secoué.
Il est recommandé de sortir le stylo du réfrigérateur 30 minutes avant l'injection. EMGALITY peut être conservé en dehors du réfrigérateur pendant une période maximale de 7 jours à des températures ne dépassant pas 30 °C.
Identité administrative
- Liste I
- Prescription réservée aux spécialistes en neurologie
- Boîte de 1 stylo prérempli, CIP 3400930170458
- Non remboursable
- Agrément aux collectivités - cf. Encadré 1 (Journal officiel du 20 janvier - texte 36)
- Laboratoire Lilly
Patients atteints de migraine sévère :
|
Pour aller plus loin
Avis de la Commission de la Transparence - EMGALITY (HAS, 24 juin 2020)
Les études pivots :
1. EVOLVE-1 : Stauffer VL, Dodick DW, Zhang Q et al. Evaluation of Galcanezumab for the Prevention of Episodic Migraine: The EVOLVE-1 Randomized Clinical Trial. JAMA Neurol. 2018
2. EVOLVE-2 : Skljarevski V, Matharu M, Millen BA et al. Efficacy and safety of galcanezumab for the prevention of episodic migraine: Results of the EVOLVE-2 Phase 3 randomized controlled clinical trial. Cephalalgia. 2018
3. REGAIN : Detke HC, Goadsby PJ, Wang S et al. Galcanezumab in chronic migraine: The randomized, double-blind, placebo- controlled REGAIN study. Neurology. 2018

 5 minutes
5 minutes Ajouter un commentaire
Ajouter un commentaire





Commentaires
Cliquez ici pour revenir à l'accueil.