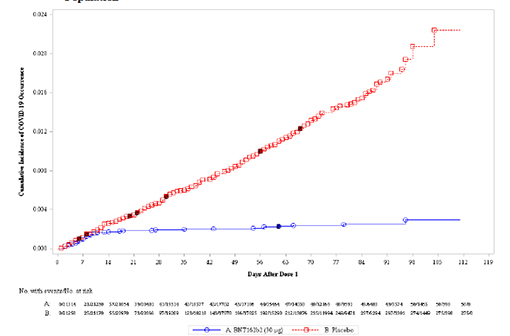
Le vaccin BNT162b de Pfizer/BioNTech protège contre les formes légères à modérées de la COVID-19 dès la première injection (en rouge le nombre de cas dans le groupe placebo, en bleu dans le groupe vacciné) (illustration.
Les documents publiés le 8 décembre 2020 sont ceux sur lesquels les experts de la FDA se sont appuyés le 10 décembre pour donner leur avis sur la mise sur le marché en urgence du vaccin BNT162b aux États-Unis. Le 8 décembre est également le jour où ce vaccin a commencé à être administré au Royaume-Uni, l'agence du médicament britannique ayant donné une autorisation d'usage en urgence (une sorte d'ATU de cohorte massive) et publié une monographie de ce vaccin, ainsi qu'un document d'information à destination des patients. Le 9 décembre, le Canada a également accordé une autorisation de ce type.
(Edit du 11 décembre 2020 : le 10 décembre, le comité d'experts indépendants de la FDA a voté en faveur d'une balance bénéfices/risques positive pour le vaccin BNT162b pour les personnes de 16 ans et plus. Le vote a été de 17 voix en faveur, 1 absention et 5 votes contre. Les experts qui ont voté contre ont justifié leur vote par l'insuffisance des données pour les patients âgés de 16 à 18 ans. Ce vote ouvre la voie à une autorisation d'usage en urgence aux Etats-Unis.)
Rappels sur le vaccin BNT162b
Comme le vaccin Moderna (mRNA-1273), BNT162b est un vaccin à ARN messager (ARNm), sans adjuvant, dont l'ARN code pour la protéine Spike (S) de SARS-CoV-2. Cet ARN est composé de nucléotides légèrement différents des nucléotides naturels pour ne pas déclencher une trop forte inflammation (notre système immunitaire détecte les ARN viraux, ce qui provoque la production de médiateurs immunitaires, en particulier des interférons). Ces ARN messagers sont encapsulés dans des nanoparticules lipidiques pour mieux pénétrer dans les cellules musculaires lors de l'injection. Après lecture par les ribosomes et synthèse de la protéine S par les cellules ayant absorbé les nanoparticules, cet ARN messager est détruit et éliminé, comme l'ensemble des ARN messagers produits par nos cellules.
Les participants de l'essai C4591001
L'essai de phase 2/3 dont les résultats viennent d'être publiés (assortis, pour rappel, de résultats d'une étude de phase 1) est un essai randomisé en double aveugle avec placebo qui a été mené essentiellement aux États-Unis, au Royaume-Uni et, dans une moindre mesure, au Brésil, en Afrique du Sud, en Allemagne et en Turquie.
Dans cette étude, 43 448 personnes de plus de 16 ans, sans antécédents de COVID-19, ont été recrutées pour recevoir deux doses de 30 µg d'ARNm administrées à 21 jours d'intervalle. Sur ces 43 448 participants, les données de 36 621 d'entre eux ont été prises en compte par la FDA.
Les promoteurs de l'essai, à la demande de la FDA, ont été vigilants quant à la diversité des profils des participants (âge, sexe, origine ethnique, comorbidités). L'âge médian était de 52 ans, avec 21,4 % de participants âgés de plus de 65 ans (N = 8 613) et 4,3 % de plus de 75 ans (N = 1 712). Environ 35 % des participants souffraient d'obésité, 24,5 % d'hypertension artérielle et 7,8 % de diabète non compliqué.
L'essai s'est déroulé du 29 avril au 14 novembre 2020. La durée de suivi médiane est d'un peu moins de 2 mois après la 2e injection (pour les données d'efficacité comme pour celles de toxicité).
Les critères d'efficacité de l'étude C4591001
Le critère principal d'efficacité retenu était l'incidence des cas de COVID-19 symptomatiques confirmés par test PCR au moins 7 jours après la seconde injection.
Les critères secondaires étaient l'incidence de l'infection au moins 14 jours après la seconde injection, l'incidence de formes sévères de COVID-19 au moins 7 jours et au moins 14 jours après la seconde injection, et l'incidence de l'infection en prenant des critères cliniques élargis pour décider de la réalisation d'un test PCR.
La mise en œuvre d'une étude d'une telle ampleur dans un contexte d'urgence a forcément abouti à quelques anomalies dans le recrutement. Par exemple, une centaine d'adolescents âgés de 12 à 15 ans ont été recrutés, ainsi que 3 % de personnes avec des antécédents de COVID-19 (révélés lors de tests sérologiques). Ces cas particuliers sont traités dans les documents d'information récemment publiés, mais n'apportent pas d'information claire, la taille de ces sous-groupes étant trop faible. Nous nous contenterons de présenter les résultats obtenus sur les personnes répondant aux critères d'inclusion tels que prédéfinis.
Une bonne immunogénicité y compris chez les personnes plus âgées
Le document publié le 8 décembre 2020 par Pfizer/BioNTech apportent des informations relatives à l'immunogénicité du vaccin BNT162b, mesurée sur 360 patients répartis entre les 2 groupes.
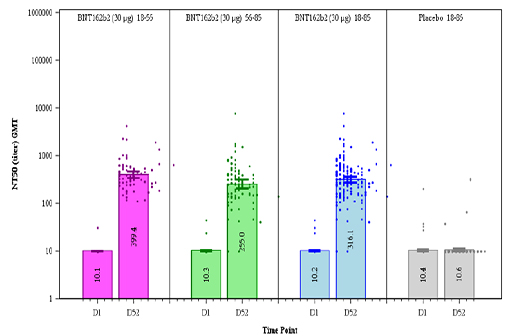
Un mois après la seconde dose, une bonne réponse immunitaire humorale a été constatée, légèrement plus faible chez les personnes de plus de 55 ans (voir figure 1 ci-dessous), mais toujours au moins équivalente à celle observée chez des patients convalescents. La neutralisation était obtenue à la fois avec la souche Wuhan originelle et la souche D614G (celle qui sévit dans les pays occidentaux depuis le printemps).
Pour rappel, les données de l'essai de phase 1, également rapportées dans le document fourni par Pfizer/BioNTech, ont montré (chez 37 sujets) une réponse immunitaire cellulaire importante (4 à 10 fois supérieure à celle observée chez des patients convalescents), en particulier concernant les lymphocytes CD8 (chez plus de 80 % des patients), dirigée contre une variété de régions de la protéine S, ainsi qu'une orientation claire de cette réponse cellulaire vers un profil Th1, avec production importante d'interféron gamma et d'interleukine-2.
Une efficacité générale de 52 % après la 1re injection, atteignant 95 % après la 2e injection
Le taux de protection observé sur l'ensemble de la cohorte au moins 7 jour après la seconde injection est de 95 % (IC 95% : 90,3-97,6), avec 8 cas de COVID-19 symptomatique confirmée dans le groupe vacciné et 162 cas dans le groupe placebo, en ligne avec les données publiées préalablement par voie de communiqués de presse.
La surprise des données rendues publiques le 8 décembre est de voir que, après la première injection, les courbes d'incidence commencent à se séparer au 10e jour (voir l'illustration en tête de cet article) et que, avant la 2e injection, le taux de protection est déjà de 52,4 % (IC 95% : 29,5-68,4), donc supérieur à la limite inférieure de protection fixée préalablement par la FDA. Même en l'absence d'information sur la durabilité de cette réponse initiale, cette information sera essentielle pour les agences réglementaires, en particulier dans un contexte de pandémie galopante aux États-Unis.
Une efficacité contre les formes sévères seulement suggérée
L'évaluation de l'efficacité du vaccin BNT162b contre les formes graves de COVID-19 est rendue délicate par le faible nombre de formes sévères observées : 1 dans le groupe vacciné (sans nécessité d'hospitalisation) et 3 dans le groupe placebo (dont 2 hospitalisations), au moins 7 jours après la seconde injection. Le taux de protection contre ces formes est de 66,4 %, mais avec un intervalle de confiance à 95 % allant de -124,8 % à 96,3 %, donc ininterprétable. Selon le document de la FDA, « les résultats ne remplissent pas les critères de succès prédéfinis (pour les formes sévères) ». Cela est probablement dû, en partie, à la relative sous-représentation des personnes à risque élevé de forme grave parmi les participants de l'étude de phase 2/3.
Lorsque les cas de formes sévères sont comptabilisés dans toute la population (au-delà des 36 621 retenus par la FDA) et dès la 1re injection, 9 cas de formes graves ont été observés dans le groupe placebo contre 1 dans le groupe vacciné, ce qui se traduit par un taux de protection de 88,9 % (IC 95% : 20,1-99,7), suggestif mais, de nouveau, insuffisant pour se prononcer.
Des analyses en sous-groupes malgré l'absence de design adéquat
Bien que l'étude C4591001 n'ait pas été conçue pour une analyse par sous-groupes, cette dernière a néanmoins été menée en post-hoc, la taille des effectifs permettant une certaine tolérance. Cette analyse par sous-groupes montre, globalement, qu'un bon niveau de protection est assuré quel que soit le sous-groupe considéré (âge, sexe, ethnicité, comorbidités) avec, bien sûr, une impossibilité à se prononcer lorsque ces sous-groupes sont de faible effectif (par exemple, les personnes d'origine asiatique ou se définissant comme multiraciales, ou les personnes souffrant d'un cancer).
L'analyse des données d'efficacité chez les personnes les plus âgées
Le taux de protection semble peu varier avec l'âge. Les moins de 56 ans ont présenté un taux de protection de 95,6 % (5 cas dans le groupe vacciné contre 114 dans le groupe placebo ; IC 95% : 89,4-98,6) et celles de plus de 55 ans un taux de 93,7 % (3 cas versus 48 cas ; IC 95% : 80,6-98,8)
Concernant les personnes les plus âgées, le taux de protection du vaccin BNT162b observé dans l'étude est de 92,9 % pour les 65-74 ans (IC 95% : 53,2-99,8 ; sur un effectif de 6 494 personnes) et de 100 % pour les plus de 75 ans (IC 95% : -12,1-100, sur un effectif de 1 617 personnes). Ce dernier résultat n'est que suggestif du fait du faible effectif et du faible nombre de cas (0 dans le groupe vacciné, 5 dans le groupe placebo). La question de la protection des plus de 75 ans demeure donc, ce qui est un point délicat alors que plusieurs gouvernements ont décidé de donner la priorité aux Ehpad pour la mise à disposition de ce vaccin.
De plus, une analyse post hoc a été menée pour les plus de 65 ans à risque élevé ou pas, et obèses ou pas :
L'analyse des données d'efficacité selon les comorbidités
L'analyse des sous-groupes présentant une comorbidité montre un taux de protection similaire au taux global :
Des effets indésirables post-injection plus sévères chez les moins de 56 ans
Les données de toxicité présentées sont rassurantes (moins de 1 % d'effets secondaires sévères), mais il semble que la bonne immunogénicité obtenue ait un prix en termes de réactions dans les jours suivant les injections.
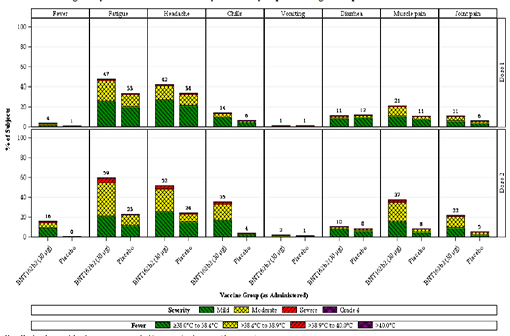
Les effets post-injection ont été particulièrement évalués chez 8 183 participants qui devaient remplir un journal électronique pendant 7 jours après chaque injection (ce qui peut avoir artificiellement augmenté la fréquence des effets rapportés, les participants étant rendus particulièrement attentifs par le dispositif de journal à remplir). Ces effets indésirables semblent être plus fréquents chez les personnes de moins de 56 ans, ainsi qu'après la 2e injection. Les effets le plus couramment observés sont la fatigue, les maux de tête et les courbatures (voir figure 2 ci-dessous).
Par exemple, après la 1re injection (attention, les pourcentages correspondent au nombre de personnes ayant signalé cet effet indésirable rapporté au "nombre de personnes ayant répondu au moins 1 oui ou non pour cet effet après cette injection" ce qui exclut les personnes n'ayant pas répondu - parce qu'elles n'ont pas ressenti cet effet ? - et gonfle artificiellement les pourcentages) :
Après la 2e injection :
Ces données ont amené un certain nombre de commentateurs à recommander de prévoir un jour de congé le lendemain de la 2e injection…
Outre les lymphadénopathies, la FDA considère que deux autres événements peuvent être liés au vaccin : une blessure de l'épaule suite aux injections et un cas d'arythmie ventriculaire chez un patient ayant des antécédents de maladie cardiaque.
Six décès (2 dans le groupe vacciné, 4 dans le groupe placebo) ont été enregistrés. Les 2 décès du groupe vacciné était dû à des accidents cardiovasculaires, le premier 62 jours après la 2e injection, le second 3 jour après la 1re injection, chez des personnes âgées de plus de 55 ans.
Les questions relatives à la toxicité qui demeurent en suspens
Malgré des résultats rassurants en termes de toxicité, y compris chez les personne à risque de forme sévère de COVID-19, des questions demeurent relatives à la sécurité du vaccin BNT162b :
Les études qui restent à faire sur BNT162b
Même si les données examinées par la FDA sont encourageantes, cette dernière insiste sur la nécessité de mener des études complémentaires pour répondre aux questions en suspens citées précédemment, tant en termes d'efficacité que de toxicité.
De plus, les experts de la FDA voient d'un mauvais œil l'intention affichée de Pfizer/BioNTech de vacciner les personnes qui se trouvent dans le groupe placebo après 6 mois de suivi post-injections. En effet, la disparition du groupe placebo exposerait à des difficultés à analyser d'éventuelles toxicités à moyen et long terme.
En conclusion, les données présentées à la FDA sur le vaccin BNT162b sont à la fois positives, avec un taux de protection dont beaucoup de vaccins rêveraient, et rassurantes avec un profil de toxicité post-injection acceptable.
Néanmoins, beaucoup de questions demeurent. Si son efficacité contre les formes légères à modérées de COVID-19 semble confirmée, il n'en est pas de même pour les formes asymptomatiques ou sévères (même si, dans ce dernier cas, les données vont dans le bon sens). La question de la protection des personnes souffrant de comorbidités reste également en suspens. Enfin, nous n'avons aucune information sur la durée de la protection accordée par ce vaccin.
De plus, et c'est une question essentielle pour le contrôle de la pandémie, nous ne savons rien sur la transmission du virus par des personnes vaccinées et néanmoins atteintes de formes asymptomatiques. En l'absence de données sur cette question, le respect des gestes barrières devra persister en dépit de la vaccination, tant que la pandémie ne sera pas contrôlée. Enfin, la question d'une éventuelle toxicité à long terme se pose toujours, ainsi que celle des effets indésirables graves et rares qui pourraient survenir.
Ces points irrésolus montrent la nécessité absolue, à la fois de poursuivre l'étude C4591001 sans vacciner le groupe placebo, de mener des études complémentaires ciblées sur ces questions et de mettre en place des mesures de vaccinovigilance efficaces, voire d'évaluation de l'efficacité de ce vaccin chez les personnes de plus de 75 ans qui vont être massivement vaccinées dans les semaines qui viennent.
Addendum : Le 10 décembre 2020, les données de l'étude C4591001 ont été publiées dans le New England Journal of Medicine (sous une forme plus digeste que les 150 pages des documents publiés par la FDA...)
©Vidal.fr
Pour aller plus loin
La monographie sur le vaccin BNT162b publiée par l'agence de régulation britannique, 8 décembre 2020.
La notice destinée aux patients britanniques recevant le vaccin BNT162b, 8 décembre 2020.
Le document d'information publié par la FDA sur le vaccin BNT162b, 8 décembre 2020.
Le document d'information publié par Pfizer/BioNTech sur le vaccin BNT162b, 8 décembre 2020.
Sur les 2 cas de réaction allergiques chez des soignants britanniques
NHS told not to give Covid vaccine to those with history of allergic reactions, The Guardian, 9 décembre 2020.
Notre article sur les risques de maladie aggravée après vaccination contre la COVID-19
Vaccins contre la COVID-19 : doit-on s'inquiéter du risque de maladie aggravée chez les personnes vaccinées ?, VIDAL Actus, 3 novembre 2020.
(Edit du 11 décembre 2020 : le 10 décembre, le comité d'experts indépendants de la FDA a voté en faveur d'une balance bénéfices/risques positive pour le vaccin BNT162b pour les personnes de 16 ans et plus. Le vote a été de 17 voix en faveur, 1 absention et 5 votes contre. Les experts qui ont voté contre ont justifié leur vote par l'insuffisance des données pour les patients âgés de 16 à 18 ans. Ce vote ouvre la voie à une autorisation d'usage en urgence aux Etats-Unis.)
Rappels sur le vaccin BNT162b
Comme le vaccin Moderna (mRNA-1273), BNT162b est un vaccin à ARN messager (ARNm), sans adjuvant, dont l'ARN code pour la protéine Spike (S) de SARS-CoV-2. Cet ARN est composé de nucléotides légèrement différents des nucléotides naturels pour ne pas déclencher une trop forte inflammation (notre système immunitaire détecte les ARN viraux, ce qui provoque la production de médiateurs immunitaires, en particulier des interférons). Ces ARN messagers sont encapsulés dans des nanoparticules lipidiques pour mieux pénétrer dans les cellules musculaires lors de l'injection. Après lecture par les ribosomes et synthèse de la protéine S par les cellules ayant absorbé les nanoparticules, cet ARN messager est détruit et éliminé, comme l'ensemble des ARN messagers produits par nos cellules.
Les participants de l'essai C4591001
L'essai de phase 2/3 dont les résultats viennent d'être publiés (assortis, pour rappel, de résultats d'une étude de phase 1) est un essai randomisé en double aveugle avec placebo qui a été mené essentiellement aux États-Unis, au Royaume-Uni et, dans une moindre mesure, au Brésil, en Afrique du Sud, en Allemagne et en Turquie.
Dans cette étude, 43 448 personnes de plus de 16 ans, sans antécédents de COVID-19, ont été recrutées pour recevoir deux doses de 30 µg d'ARNm administrées à 21 jours d'intervalle. Sur ces 43 448 participants, les données de 36 621 d'entre eux ont été prises en compte par la FDA.
Les promoteurs de l'essai, à la demande de la FDA, ont été vigilants quant à la diversité des profils des participants (âge, sexe, origine ethnique, comorbidités). L'âge médian était de 52 ans, avec 21,4 % de participants âgés de plus de 65 ans (N = 8 613) et 4,3 % de plus de 75 ans (N = 1 712). Environ 35 % des participants souffraient d'obésité, 24,5 % d'hypertension artérielle et 7,8 % de diabète non compliqué.
L'essai s'est déroulé du 29 avril au 14 novembre 2020. La durée de suivi médiane est d'un peu moins de 2 mois après la 2e injection (pour les données d'efficacité comme pour celles de toxicité).
Les critères d'efficacité de l'étude C4591001
Le critère principal d'efficacité retenu était l'incidence des cas de COVID-19 symptomatiques confirmés par test PCR au moins 7 jours après la seconde injection.
Les critères secondaires étaient l'incidence de l'infection au moins 14 jours après la seconde injection, l'incidence de formes sévères de COVID-19 au moins 7 jours et au moins 14 jours après la seconde injection, et l'incidence de l'infection en prenant des critères cliniques élargis pour décider de la réalisation d'un test PCR.
La mise en œuvre d'une étude d'une telle ampleur dans un contexte d'urgence a forcément abouti à quelques anomalies dans le recrutement. Par exemple, une centaine d'adolescents âgés de 12 à 15 ans ont été recrutés, ainsi que 3 % de personnes avec des antécédents de COVID-19 (révélés lors de tests sérologiques). Ces cas particuliers sont traités dans les documents d'information récemment publiés, mais n'apportent pas d'information claire, la taille de ces sous-groupes étant trop faible. Nous nous contenterons de présenter les résultats obtenus sur les personnes répondant aux critères d'inclusion tels que prédéfinis.
Une bonne immunogénicité y compris chez les personnes plus âgées
Le document publié le 8 décembre 2020 par Pfizer/BioNTech apportent des informations relatives à l'immunogénicité du vaccin BNT162b, mesurée sur 360 patients répartis entre les 2 groupes.
Un mois après la seconde dose, une bonne réponse immunitaire humorale a été constatée, légèrement plus faible chez les personnes de plus de 55 ans (voir figure 1 ci-dessous), mais toujours au moins équivalente à celle observée chez des patients convalescents. La neutralisation était obtenue à la fois avec la souche Wuhan originelle et la souche D614G (celle qui sévit dans les pays occidentaux depuis le printemps).

Figure 1 : La réaction immunitaire humorale provoquée par le vaccin Pfizer/BioNTech est neutralisante, y compris chez les personnes de plus de 55 ans. Colonne de gauche : le jour de la 1re injection ; colonne de droite : un mois après la 2e injection. Barres roses : 15-55 ans ; barres vertes : 56-85 ans ; barres bleues ; 15-85 ans ; barres grises : groupe placebo.
Pour rappel, les données de l'essai de phase 1, également rapportées dans le document fourni par Pfizer/BioNTech, ont montré (chez 37 sujets) une réponse immunitaire cellulaire importante (4 à 10 fois supérieure à celle observée chez des patients convalescents), en particulier concernant les lymphocytes CD8 (chez plus de 80 % des patients), dirigée contre une variété de régions de la protéine S, ainsi qu'une orientation claire de cette réponse cellulaire vers un profil Th1, avec production importante d'interféron gamma et d'interleukine-2.
Une efficacité générale de 52 % après la 1re injection, atteignant 95 % après la 2e injection
Le taux de protection observé sur l'ensemble de la cohorte au moins 7 jour après la seconde injection est de 95 % (IC 95% : 90,3-97,6), avec 8 cas de COVID-19 symptomatique confirmée dans le groupe vacciné et 162 cas dans le groupe placebo, en ligne avec les données publiées préalablement par voie de communiqués de presse.
La surprise des données rendues publiques le 8 décembre est de voir que, après la première injection, les courbes d'incidence commencent à se séparer au 10e jour (voir l'illustration en tête de cet article) et que, avant la 2e injection, le taux de protection est déjà de 52,4 % (IC 95% : 29,5-68,4), donc supérieur à la limite inférieure de protection fixée préalablement par la FDA. Même en l'absence d'information sur la durabilité de cette réponse initiale, cette information sera essentielle pour les agences réglementaires, en particulier dans un contexte de pandémie galopante aux États-Unis.
Une efficacité contre les formes sévères seulement suggérée
L'évaluation de l'efficacité du vaccin BNT162b contre les formes graves de COVID-19 est rendue délicate par le faible nombre de formes sévères observées : 1 dans le groupe vacciné (sans nécessité d'hospitalisation) et 3 dans le groupe placebo (dont 2 hospitalisations), au moins 7 jours après la seconde injection. Le taux de protection contre ces formes est de 66,4 %, mais avec un intervalle de confiance à 95 % allant de -124,8 % à 96,3 %, donc ininterprétable. Selon le document de la FDA, « les résultats ne remplissent pas les critères de succès prédéfinis (pour les formes sévères) ». Cela est probablement dû, en partie, à la relative sous-représentation des personnes à risque élevé de forme grave parmi les participants de l'étude de phase 2/3.
Lorsque les cas de formes sévères sont comptabilisés dans toute la population (au-delà des 36 621 retenus par la FDA) et dès la 1re injection, 9 cas de formes graves ont été observés dans le groupe placebo contre 1 dans le groupe vacciné, ce qui se traduit par un taux de protection de 88,9 % (IC 95% : 20,1-99,7), suggestif mais, de nouveau, insuffisant pour se prononcer.
Des analyses en sous-groupes malgré l'absence de design adéquat
Bien que l'étude C4591001 n'ait pas été conçue pour une analyse par sous-groupes, cette dernière a néanmoins été menée en post-hoc, la taille des effectifs permettant une certaine tolérance. Cette analyse par sous-groupes montre, globalement, qu'un bon niveau de protection est assuré quel que soit le sous-groupe considéré (âge, sexe, ethnicité, comorbidités) avec, bien sûr, une impossibilité à se prononcer lorsque ces sous-groupes sont de faible effectif (par exemple, les personnes d'origine asiatique ou se définissant comme multiraciales, ou les personnes souffrant d'un cancer).
L'analyse des données d'efficacité chez les personnes les plus âgées
Le taux de protection semble peu varier avec l'âge. Les moins de 56 ans ont présenté un taux de protection de 95,6 % (5 cas dans le groupe vacciné contre 114 dans le groupe placebo ; IC 95% : 89,4-98,6) et celles de plus de 55 ans un taux de 93,7 % (3 cas versus 48 cas ; IC 95% : 80,6-98,8)
Concernant les personnes les plus âgées, le taux de protection du vaccin BNT162b observé dans l'étude est de 92,9 % pour les 65-74 ans (IC 95% : 53,2-99,8 ; sur un effectif de 6 494 personnes) et de 100 % pour les plus de 75 ans (IC 95% : -12,1-100, sur un effectif de 1 617 personnes). Ce dernier résultat n'est que suggestif du fait du faible effectif et du faible nombre de cas (0 dans le groupe vacciné, 5 dans le groupe placebo). La question de la protection des plus de 75 ans demeure donc, ce qui est un point délicat alors que plusieurs gouvernements ont décidé de donner la priorité aux Ehpad pour la mise à disposition de ce vaccin.
De plus, une analyse post hoc a été menée pour les plus de 65 ans à risque élevé ou pas, et obèses ou pas :
- personnes de plus de 65 ans sans facteur de risque : 100 % (29,5-100, N = 3 643) ;
- personnes de plus de 65 ans avec facteur de risque : 91,7 % (44,2-99,8, N = 4 468) ;
- personnes de plus de 65 ans non obèses : 91,8 % (44,7-99,8, N = 5 400) ;
- personnes de plus de 65 ans obèses : 100 % (27,4-100, N = 2 710).
L'analyse des données d'efficacité selon les comorbidités
L'analyse des sous-groupes présentant une comorbidité montre un taux de protection similaire au taux global :
- personnes obèses (IMC supérieur ou égal 30 kg/m²) : 95,4 % (86,0-99,1, N = 12 103) ;
- personnes diabétiques (hors diabète gestationnel) : 94,7 % (66,8-99,9, N = 2 746) ;
- personnes hypertendues : 95,4 % (82,6-99,5, N = 8 850) ;
- personnes présentant une maladie respiratoire chronique : 93 % (54,1-99,8, N= 2 732).
Ces résultats vont dans le bon sens, mais demandent à être confirmés dans des études dédiées.
Les questions relatives à l'efficacité qui demeurent en suspens
Si les résultats rendus publics par Pfizer/BioNTech et la FDA sont rassurants sur l'efficacité globale du vaccin BNT162b au cours des 2 mois suivant la 2e injection, de nombreuses questions sur cette efficacité demeurent sans réponse :
Les questions relatives à l'efficacité qui demeurent en suspens
Si les résultats rendus publics par Pfizer/BioNTech et la FDA sont rassurants sur l'efficacité globale du vaccin BNT162b au cours des 2 mois suivant la 2e injection, de nombreuses questions sur cette efficacité demeurent sans réponse :
- la persistance de la protection obtenue dans le temps ;
- l'efficacité parmi les populations vulnérables aux formes graves (en particulier les insuffisants rénaux et les personnes immunodéprimées) ;
- l'efficacité chez les personnes ayant des antécédents de COVID-19 (même si l'analyse post hoc semble suggérer une efficacité dans ce groupe, celui-ci est trop petit pour conclure) ;
- l'efficacité chez les enfants et les moins de 16 ans ;
- l'efficacité contre les formes asymptomatiques de la COVID-19 ;
- l'efficacité contre les formes graves et l'effet sur la mortalité ;
- l'efficacité contre les effets à long terme des infections acquises malgré le vaccin ;
- l'efficacité sur la transmission du virus en cas de contamination d'une personne malgré le vaccin ;
- le futur de cette efficacité si la pandémie venait à évoluer (mutations de SARS-CoV-2 par exemple).
Des effets indésirables post-injection plus sévères chez les moins de 56 ans
Les données de toxicité présentées sont rassurantes (moins de 1 % d'effets secondaires sévères), mais il semble que la bonne immunogénicité obtenue ait un prix en termes de réactions dans les jours suivant les injections.
Les effets post-injection ont été particulièrement évalués chez 8 183 participants qui devaient remplir un journal électronique pendant 7 jours après chaque injection (ce qui peut avoir artificiellement augmenté la fréquence des effets rapportés, les participants étant rendus particulièrement attentifs par le dispositif de journal à remplir). Ces effets indésirables semblent être plus fréquents chez les personnes de moins de 56 ans, ainsi qu'après la 2e injection. Les effets le plus couramment observés sont la fatigue, les maux de tête et les courbatures (voir figure 2 ci-dessous).
Par exemple, après la 1re injection (attention, les pourcentages correspondent au nombre de personnes ayant signalé cet effet indésirable rapporté au "nombre de personnes ayant répondu au moins 1 oui ou non pour cet effet après cette injection" ce qui exclut les personnes n'ayant pas répondu - parce qu'elles n'ont pas ressenti cet effet ? - et gonfle artificiellement les pourcentages) :
- la fatigue est observée chez 47,4 % des moins de 56 ans et 34,1 % des plus de 55 ans ;
- les maux de tête chez 41,9 % des moins de 56 ans et 25,2 % des plus de 55 ans ;
- les courbatures chez 21,3 % des moins de 56 ans et 13,9 % des plus de 55 ans ;
- le recours au paracétamol est de 27,8 % chez les moins de 56 ans et de 19,9 % chez les plus de 55 ans.
Après la 2e injection :
- fatigue : 59,4 % versus 50,5 % ;
- maux de tête : 51,7 % versus 39 % ;
- courbatures : 37,3 % versus 28,7 % ;
- recours au paracétamol : 45 % versus 37,7 %.
Ces données ont amené un certain nombre de commentateurs à recommander de prévoir un jour de congé le lendemain de la 2e injection…

Figure 2 : Les réactions aux injections du vaccin Pfizer/BioNTech chez les personnes de moins de 56 ans sollicitées pour tenir un journal post-injection (à gauche : groupe vacciné ; à droite : groupe placebo).
Ligne du haut : 1re injection ; ligne du bas : 2e injection
Colonnes, de gauche à droite : fièvre, fatigue, maux de tête, frissons, vomissements, diarrhée, courbatures, douleurs articulaires.
Ligne du haut : 1re injection ; ligne du bas : 2e injection
Colonnes, de gauche à droite : fièvre, fatigue, maux de tête, frissons, vomissements, diarrhée, courbatures, douleurs articulaires.
Mais, lorsqu'on examine les pourcentages d'effets indésirables post-injection dans la population totale évaluée par Pfizer/BioNTech (N=37 586), une autre image de la fréquence des effets indésirables post-injection émerge. Dans cette population (sans sollicitation via un journal électronique), 6,1 % ont signalé de la fièvre, 5,3 % des frissons, 5,5 % de la fatigue, 5,1 % des maux de tête et 4,8 % des courbatures. Ces pourcentages étaient plus élevés dans le groupe des moins de 56 ans (respectivement, 7,6 %, 6,4 %, 6,4 %, 6 % et 5,8 %).
Ainsi, il est possible que l'effet loupe de la sollicitation spécifique d'un sous-groupe pour le signalement des effets indésirables post-injection ait été important. Pour corriger cet effet loupe, il est nécessaire de comparer, pour les chiffres du sous-groupe spécifique, les pourcentages obtenus dans le groupe vacciné à ceux du groupe placebo (également élevés).
Le 10 décembre 2020, la presse britannique a rapporté 2 cas de réactions d'hypersensibilité chez des soignants fraîchement vaccinés avec BNT162b. Ces soignants présentaient des antécédents d'allergie justifiant la possession d'un stylo injecteur d'adrénaline. En conséquence, le National Health Service (NHS) recommande de ne pas administrer ce vaccin aux personnes présentant des antécédents de maladie allergique. De fait, les sujets ayant des antécédents d'anaphylaxie étaient exclus de l'étude C4591001.
(Edit du 17 décembre 2020) Le 17 décembre 2020, la FDA a signalé deux autres cas de réactions allergiques sévères chez des personnes vaccinées en Alaska, dont une seule avait des antécédents de maladie allergique.
Les autres données de toxicité
Parmi les autres effets indésirables observés, certains attirent l'attention par leur fréquence plus importante dans le groupe vacciné :
Ainsi, il est possible que l'effet loupe de la sollicitation spécifique d'un sous-groupe pour le signalement des effets indésirables post-injection ait été important. Pour corriger cet effet loupe, il est nécessaire de comparer, pour les chiffres du sous-groupe spécifique, les pourcentages obtenus dans le groupe vacciné à ceux du groupe placebo (également élevés).
Le 10 décembre 2020, la presse britannique a rapporté 2 cas de réactions d'hypersensibilité chez des soignants fraîchement vaccinés avec BNT162b. Ces soignants présentaient des antécédents d'allergie justifiant la possession d'un stylo injecteur d'adrénaline. En conséquence, le National Health Service (NHS) recommande de ne pas administrer ce vaccin aux personnes présentant des antécédents de maladie allergique. De fait, les sujets ayant des antécédents d'anaphylaxie étaient exclus de l'étude C4591001.
(Edit du 17 décembre 2020) Le 17 décembre 2020, la FDA a signalé deux autres cas de réactions allergiques sévères chez des personnes vaccinées en Alaska, dont une seule avait des antécédents de maladie allergique.
Les autres données de toxicité
Parmi les autres effets indésirables observés, certains attirent l'attention par leur fréquence plus importante dans le groupe vacciné :
- des lymphadénopathies des aisselles ou du cou, 2 à 4 jours après l'injection (64 cas dans le groupe vacciné contre 6 dans le groupe placebo) qui font pencher les experts de la FDA et le laboratoire vers un effet indésirable dû à la vaccination pour au moins 47 d'entre elles ;
- des paralysies du nerf facial (paralysie de Bell, 4 dans le groupe vacciné, 0 dans le groupe placebo), mais les experts de la FDA relèvent que 4 cas sur environ 20 000 personnes suivies pendant 2 mois correspond à la fréquence habituelle de cette affection ;
- des appendicites (8 dans le groupe vacciné, 4 dans le groupe placebo), mais sans différence statistiquement significative entre les deux groupes (p=0,38).
Outre les lymphadénopathies, la FDA considère que deux autres événements peuvent être liés au vaccin : une blessure de l'épaule suite aux injections et un cas d'arythmie ventriculaire chez un patient ayant des antécédents de maladie cardiaque.
Six décès (2 dans le groupe vacciné, 4 dans le groupe placebo) ont été enregistrés. Les 2 décès du groupe vacciné était dû à des accidents cardiovasculaires, le premier 62 jours après la 2e injection, le second 3 jour après la 1re injection, chez des personnes âgées de plus de 55 ans.
Les questions relatives à la toxicité qui demeurent en suspens
Malgré des résultats rassurants en termes de toxicité, y compris chez les personne à risque de forme sévère de COVID-19, des questions demeurent relatives à la sécurité du vaccin BNT162b :
- la possibilité d'effets indésirables graves, rares ou décalés dans le temps ;
- la possibilité de COVID-19 aggravée par la vaccination (voir notre article sur le sujet), même si le moindre nombre de formes sévères dans le groupe vacciné est rassurant ;
- la toxicité chez les moins de 16 ans, les femmes enceintes et allaitantes et les personnes immunodéprimées.
Les études qui restent à faire sur BNT162b
Même si les données examinées par la FDA sont encourageantes, cette dernière insiste sur la nécessité de mener des études complémentaires pour répondre aux questions en suspens citées précédemment, tant en termes d'efficacité que de toxicité.
De plus, les experts de la FDA voient d'un mauvais œil l'intention affichée de Pfizer/BioNTech de vacciner les personnes qui se trouvent dans le groupe placebo après 6 mois de suivi post-injections. En effet, la disparition du groupe placebo exposerait à des difficultés à analyser d'éventuelles toxicités à moyen et long terme.
En conclusion, les données présentées à la FDA sur le vaccin BNT162b sont à la fois positives, avec un taux de protection dont beaucoup de vaccins rêveraient, et rassurantes avec un profil de toxicité post-injection acceptable.
Néanmoins, beaucoup de questions demeurent. Si son efficacité contre les formes légères à modérées de COVID-19 semble confirmée, il n'en est pas de même pour les formes asymptomatiques ou sévères (même si, dans ce dernier cas, les données vont dans le bon sens). La question de la protection des personnes souffrant de comorbidités reste également en suspens. Enfin, nous n'avons aucune information sur la durée de la protection accordée par ce vaccin.
De plus, et c'est une question essentielle pour le contrôle de la pandémie, nous ne savons rien sur la transmission du virus par des personnes vaccinées et néanmoins atteintes de formes asymptomatiques. En l'absence de données sur cette question, le respect des gestes barrières devra persister en dépit de la vaccination, tant que la pandémie ne sera pas contrôlée. Enfin, la question d'une éventuelle toxicité à long terme se pose toujours, ainsi que celle des effets indésirables graves et rares qui pourraient survenir.
Ces points irrésolus montrent la nécessité absolue, à la fois de poursuivre l'étude C4591001 sans vacciner le groupe placebo, de mener des études complémentaires ciblées sur ces questions et de mettre en place des mesures de vaccinovigilance efficaces, voire d'évaluation de l'efficacité de ce vaccin chez les personnes de plus de 75 ans qui vont être massivement vaccinées dans les semaines qui viennent.
Addendum : Le 10 décembre 2020, les données de l'étude C4591001 ont été publiées dans le New England Journal of Medicine (sous une forme plus digeste que les 150 pages des documents publiés par la FDA...)
©Vidal.fr
Pour aller plus loin
La monographie sur le vaccin BNT162b publiée par l'agence de régulation britannique, 8 décembre 2020.
La notice destinée aux patients britanniques recevant le vaccin BNT162b, 8 décembre 2020.
Le document d'information publié par la FDA sur le vaccin BNT162b, 8 décembre 2020.
Le document d'information publié par Pfizer/BioNTech sur le vaccin BNT162b, 8 décembre 2020.
Sur les 2 cas de réaction allergiques chez des soignants britanniques
NHS told not to give Covid vaccine to those with history of allergic reactions, The Guardian, 9 décembre 2020.
Notre article sur les risques de maladie aggravée après vaccination contre la COVID-19
Vaccins contre la COVID-19 : doit-on s'inquiéter du risque de maladie aggravée chez les personnes vaccinées ?, VIDAL Actus, 3 novembre 2020.
Pour aller plus loin
Consultez les monographies VIDAL
Sources
Commentaires
Ajouter un commentaire
En cliquant sur "Ajouter un commentaire", vous confirmez être âgé(e) d'au moins 16 ans et avoir lu et accepté les règles et conditions d'utilisation de l'espace participatif "Commentaires" .
Nous vous invitons à signaler tout effet indésirable susceptible d'être dû à un médicament en le déclarant en ligne.
Les plus récents

Pour recevoir gratuitement toute l’actualité par mail Je m'abonne !

 14 minutes
14 minutes 13 commentaires
13 commentaires 






Autant pour moi, voici l'étude en question :
https://clinicaltrials.gov/ct2/show/NCT04368728
Bonjour, le lien que vous mentionnez est un appel à candidat pour une étude qui aboutira le 2 mai 2023. Et il ne s'agira que de candidats sains.
Le titre traduit de l'article : " Étude pour décrire l'innocuité, la tolérabilité, l'immunogénicité et l'efficacité des candidats vaccins à ARN contre le COVID-19 chez des individus sains "
Cette étude, tardive, ne démontrera pas la compétence du vaccin aux formes sévères.
A ce jour, il ne semble pas y avoir d'études sur ce sujet, ormis celle que vous mentionnez de PFIZER/BIONTECH sur 927. Cette étude date d'avril 2021. Nous attendons donc son analyse et la validation de sa pertinance à la vue des groupes d'études choisis.
Cordialement,
A.C.
Vous dites :
« le vaccin BioNTech Pfizer (COMIRNATY) est très efficace pour prévenir les formes sévères de la COVID-19, y compris chez les personnes âgées, y compris pour les variants Alpha, Bêta, Gamma et Delta.» en faisant référence à un communiqué de presse Pfizer/Biontech publié le 1er Avril 2021 au sujet de leurs essais. Voici le lien : https://www.businesswire.com/news/home/20210401005365/en/
Sauf erreur de ma part À AUCUN MOMENT il n'est fait mention de personnes agées et de cas graves. Merci de bien vouloir corriger votre correctif en urgence ou d'y apporter des preuves plus consistantes !
Le lien ne fait pas référence à un communiqué de presse mais à un article qui analyse les données obtenues en population générale : https://www.vidal.fr/actualites/27163-vaccin-comirnaty-contre-la-covid-19-quelle-efficacite-contre-les-formes-severes-des-personnes-agees.html
il s'agit d'observations et non d'études cliniques en double aveugle randomisées
https://youtu.be/u4oNUJPR4uw?t=882
il ne s'agit pas d'études mais d'estimations
en plus - je donne un exemple pour ne pas encombre - une astérisque dans le texte de l'estimation française explique que :
la réduction de risque constatée pour cette période de suivi reflète probablementle fait que les cas contactet les personnes présentant des symptômes de COVID-19 étaient écartés de la vaccination
ainsi, pour le moment, rien ne permet de confirmer que le vaccin ait un quelconque effet, en dépit des prétention du fabricant/vendeur. Merci.
https://www.nejm.org/doi/full/10.1056/NEJMc2104974 : "Vaccine effectiveness against severe, critical, or fatal disease due to infection with any SARS-CoV-2 (with the B.1.1.7 and B.1.351 variants being predominant within Qatar) was very high, at 97.4% (95% CI, 92.2 to 99.5)."
je vous remercie pour la mise à jour de votre article.
Cependant vous indiquez un lien censé démontrer l'efficacité du vaccin PFIZER/BIONTECH sur les formes sévères de la COVID-19, et vous précisez en particulier chez les personnes âgées, cependant votre lien nous renvoit vers un autre article intitulé : " Vaccin COMIRNATY contre la COVID-19 : quelle efficacité contre les formes sévères des personnes âgées?", où on apprend que selon quelques études britanique, française et israëlienne, ce vaccin réduirait les formes sévères de la COVID-19, mais esclusivement sur les personnes âgées, aucune étude mentionnée n'a étudié les moins de 75ans.
Sauf erreur de ma part, merci donc de revoir votre mise à jour du 02 juillet 2021 en indiquant que le vaccin est efficace pour les formes graves chez les personnes agées, ou de changer votre lien vers une étude plsu globale.
Cordialement,
A.C.
Je me permets de vous reprendre,, vous indiquez " Cette étude a porté essentiellement sur des personnes de moins de 75 ans et montre clairement une efficacité dans cette population " mais votre lien porte esclusivement sur les PLUS de 75ans et pas du tout sur le smoins de 75ans. Merci de modifier votre lien ou de changer votre phrase.
"Vaccine effectiveness against severe, critical, or fatal disease due to infection with any SARS-CoV-2 (with the B.1.1.7 and B.1.351 variants being predominant within Qatar) was very high, at 97.4% (95% CI, 92.2 to 99.5)." dans l'article du NEJM cité.
Lisez attentivement l'article ci-dessus, vous aurez des réponses sur l'efficacité contre les formes graves chez les 18-75 ans. Vous en trouverez également dans l'article suivant (sur les variants) : https://www.nejm.org/doi/full/10.1056/NEJMc2104974
"Vaccine effectiveness against severe, critical, or fatal disease due to infection with any SARS-CoV-2 (with the B.1.1.7 and B.1.351 variants being predominant within Qatar) was very high, at 97.4% (95% CI, 92.2 to 99.5)." dans l'article du NEJM cité.