Une proportion encore élevée (20 %) de personnes infectées par le VIH en France ignorent leur séropositivité (illustration).
Nouveau comprimé dosé à 600 mg de raltégravir
Un nouveau dosage d'ISENTRESS comprimé pelliculé, à 600 mg de raltégravir, est désormais disponible.
Cette nouvelle présentation, la plus dosée de la gamme ISENTRESS, est indiquée en association avec d'autres médicaments antirétroviraux dans le traitement de l'infection par le virus de l'immunodéficience humaine (VIH-1), chez les adultes et les enfants pesant au moins 40 kg (Cf. VIDAL Reco « Infection par le VIH »).
Elle s'ajoute notamment à la présentation ISENTRESS 400 mg comprimé pelliculé, utilisée chez les patients pesant au moins 25 kg, dans la même indication thérapeutique.
D'autres présentations, en comprimé à croquer (25 mg et 100 mg) et en granulés pour suspension buvable (100 mg), sont également disponibles pour les jeunes enfants et les nourrissons. Ces formulations ayant des profils pharmacocinétiques différents, elles ne doivent pas être remplacés par le comprimé à 400 mg ou le comprimé à 600 mg.
Schéma thérapeutique simplifié : une seule prise par jour
La posologie recommandée d'ISENTRESS 600 mg comprimé pelliculé est de 1 200 mg (2 comprimés) 1 fois par jour pour les patients naïfs de traitement ou les patients virologiquement contrôlés par un traitement initial d'ISENTRESS 400 mg 2 fois par jour.
ISENTRESS 600 mg x 2 comprimés 1 fois par jour permet une simplification thérapeutique par rapport à ISENTRESS 400 mg x 1 comprimé 2 fois par jour chez les patients adultes et les enfants (pesant au moins 40 kg), naïfs de traitement ou virologiquement contrôlés par un traitement initial à base d'ISENTRESS 400 mg.
Le comprimé à 400 mg ne doit pas être utilisé pour le schéma posologique à 1 200 mg en une prise par jour.
Non-infériorité démontrée versus le dosage à 400 mg x 2/jour
L'évaluation de l'efficacité l'ISENTRESS 600 mg selon un schéma en 1 prise (1 200 mg) repose sur les résultats d'une étude de non infériorité de phase III, contrôlée, randomisée en double aveugle (ONCEMRK), versus raltégravir 400 mg 2 fois par jour, chacun en co-administration avec l'emtricitabine/fumarate de ténofovir disoproxil (TRUVADA) à raison d'un comprimé par jour.
Cette étude a été mené chez des patients infectés par le VIH-1, âgés de plus de 18 ans, dont la charge virale était supérieure ou égale à 1 000 copies/mL et naïfs de traitement antirétroviral.
Le critère de jugement principal était la proportion de patients ayant une charge virale inférieure à 40 copies/mL après 48 semaines.
Selon les résultats de cette étude, la non-infériorité d'ISENTRESS 600 mg a été démontrée par rapport à ISENTRESS 400 mg dans l'analyse FAS (Full analysis set : ensemble des patients randomisés ayant reçu au moins une dose de traitement et disposant d'au moins une mesure du critère principal étudié), et confirmée dans l'analyse per protocole (Cf. Tableau I).
Tableau I - Etude ONCEMRK : résultats d'efficacité à 48 semaines
(d'après avis de la Commission de la transparence, 6 décembre 2017)
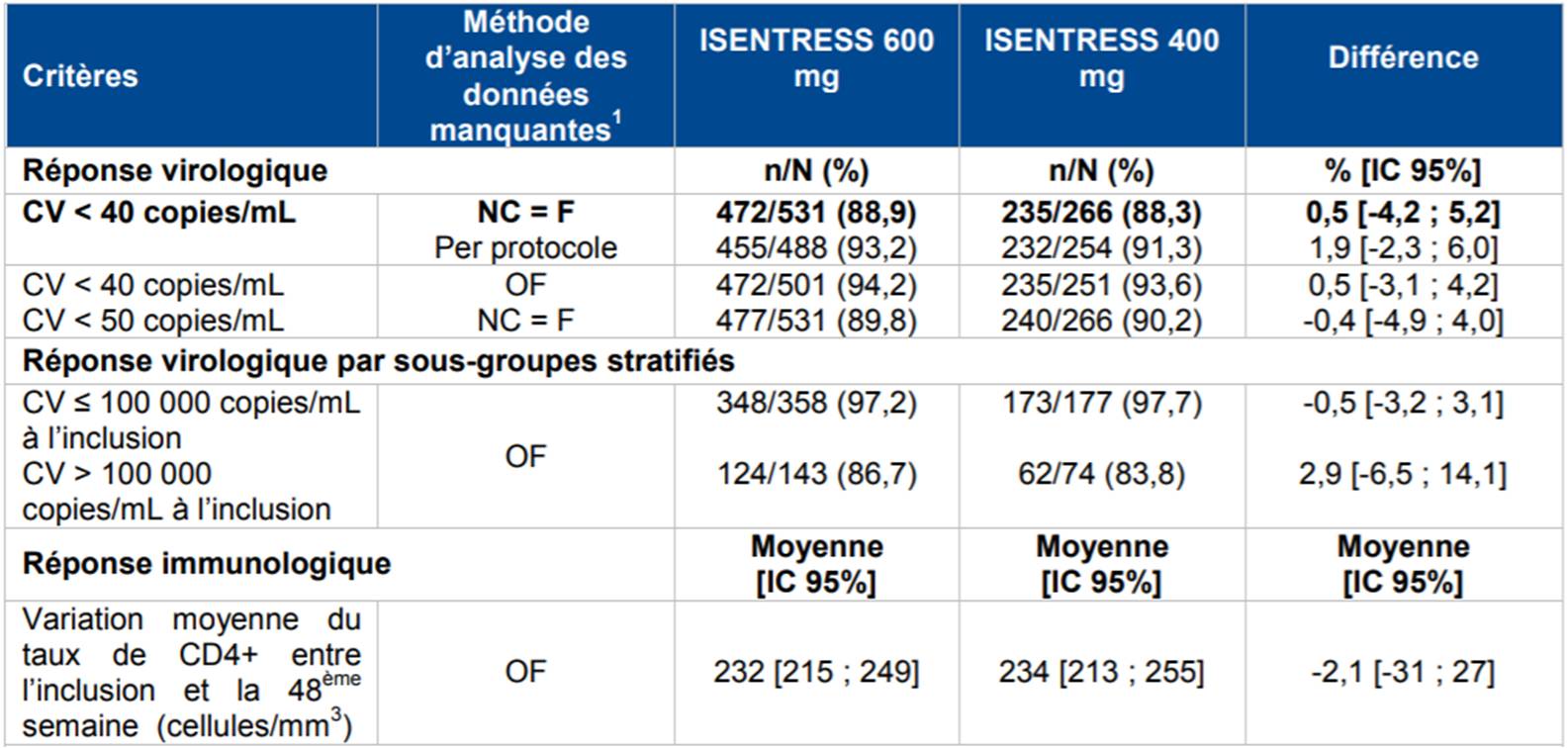 OF : Méthode Observed Failure, les patients ayant arrêté prématurément le traitement étaient considérés comme en échec de traitement, les autres patients ayant des données manquantes étaient écartés de l'analyse. NC = F : Méthode Non Completer (NC) = Failure (F), définie par la FDA comme étant l'approche "Snapshot". Selon cette approche, étaient considérés contrôlés les patients traités en double insu, dont les mesures de l'ARN-VIH respectaient les conditions de mesures définies dans l'essai, et qui avaient une charge virale < 40 copies/mL aux semaines 48 et 96. Les patients considérés en échec virologique étaient ceux dont la charge virale était supérieure ou égale à 40 copies/mL ou ceux sans données virologiques à la suite de l'arrêt intermittent ou de l'interruption prématurée de l'essai
OF : Méthode Observed Failure, les patients ayant arrêté prématurément le traitement étaient considérés comme en échec de traitement, les autres patients ayant des données manquantes étaient écartés de l'analyse. NC = F : Méthode Non Completer (NC) = Failure (F), définie par la FDA comme étant l'approche "Snapshot". Selon cette approche, étaient considérés contrôlés les patients traités en double insu, dont les mesures de l'ARN-VIH respectaient les conditions de mesures définies dans l'essai, et qui avaient une charge virale < 40 copies/mL aux semaines 48 et 96. Les patients considérés en échec virologique étaient ceux dont la charge virale était supérieure ou égale à 40 copies/mL ou ceux sans données virologiques à la suite de l'arrêt intermittent ou de l'interruption prématurée de l'essaiEn termes de tolérance, les données de cette étude ont été conformes au profil connu du réltégravir avec, pour principaux effets secondaires (fréquence de 5 % ou plus) : des céphalées, des nausées et des douleurs abdominales.
Les effets indésirables graves les plus fréquemment rapportés sont des syndromes de restauration immunitaire et des éruptions cutanées graves.
Sur la base des résultats de cette étude, la Commission de la transparence considère qu'ISENTRESS 600 mg apporte un service médical rendu (SMR) important, sans amélioration du SMR (ASMR V) par rapport aux autres présentations d'ISENTRESS actuellement disponibles (Cf. avis du 6 décembre 2017).
Compte tenu de la barrière génétique à la résistance du raltégravir relativement faible, la Commission recommande d'associer ISENTRESS 600 avec des antirétroviraux pleinement actifs et de respecter une bonne observance du traitement.
Identité administrative d'ISENTRESS 600 mg comprimé pelliculé
- Liste I
- Prescription initiale hospitalière annuelle
- Renouvellement non restreint
- Flacon de 60, CIP 3400930104002
- Remboursable à 100 %
- Agrément aux collectivités
- Prix public TTC = 556,06 euros
- Laboratoire MSD France
Pour aller plus loin
Avis de la Commission de la transparence - ISENTRESS 600 mg (HAS, 6 décembre 2017)
Pour aller plus loin
Consultez les monographies VIDAL
Consultez les VIDAL Recos
Sources
Pour recevoir gratuitement toute l’actualité par mail Je m'abonne !

 4 minutes
4 minutes Ajouter un commentaire
Ajouter un commentaire.jpg)

.jpg)




Commentaires
Cliquez ici pour revenir à l'accueil.