
Le mélanome est un cancer cutané à fort potentiel métastatique (illustration).
MEKINIST est un inhibiteur des protéines kinases d'une nouvelle classe pharmacothérapeutique, les anti-MEK (mitogen-activated extracellular signal regulated kinase).
Son principe actif, le tramétinib, est un inhibiteur allostérique réversible et hautement sélectif de l'activation des protéines MEK 1 et 2. Celles-ci sont capables d'activer les protéines ERK (extracellular signal-related kinases) 1 et 2 impliquées dans l'une des principales voies de prolifération et survie cellulaire. Certains patients atteints d'un mélanome expriment une forme mutée de la protéine B-RAF responsable d'une suractivation de MEK 1 et 2.
MEKINIST a obtenu une autorisation de mise sur le marché (AMM) européenne en monothérapie ou en association au dabrafénib (TAFINLAR) dans le traitement des patients adultes atteints d'un mélanome non résécable ou métastatique porteur d'une mutation B-RAF V600 (Cf. VIDAL Reco "Mélanome cutané").
Le tramétinib en monothérapie n'a pas démontré d'activité clinique chez les patients dont la maladie a progressé au cours d'un traitement antérieur par un inhibiteur de BRAF.
MEKINIST est disponible en ville et à l'hôpital sous forme de comprimés pelliculés dosés à 0,5 mg et 2 mg de tramétinib, dont les prix de vente (hors honoraires de dispensation) s'élèvent respectivement à 1 498,83 euros et 5 643,29 euros (le flacon de 30 comprimés).
MEKINIST est remboursable à 100 % et agréé aux collectivités dans son indication en association au drafétinab.
SMR important et ASMR III (modérée)
L'efficacité du tramétinib en association avec le dabrafénib a été évaluée par la Commission de la transparence (CT) sur la base de deux études randomisées de phase III conduites chez des patients avec un mélanome avancé (non résécable ou métastatique), porteurs d'une mutation B-RAF V600 (Cf. avis du 20 janvier 2016) :
- L'étude COMBI-d (MEK155306) [Long GV, N Engl J Med. 2014], menée en double aveugle versus dabrafenib en monothérapie auprès de 423 patients :
- Le critère de jugement principal était la survie sans progression (SSP).
- La médiane de survie sans progression (SSP) a été estimée à 9,3 mois dans le groupe tramétinib + dabrafénib versus 8,8 mois dans le groupe dabrafénib (HR = 0,75 ; IC95% = [0,57-0,99] ; p = 0,035). Lors de l'analyse finale de la survie globale (janvier 2015), ces valeurs ont respectivement été évaluées à 11 mois versus 8,8 mois (Cf. Figure 1).
Figure 1 : courbes de survie sans progression (Kaplan-meier) d'après l'étude COMBI-d
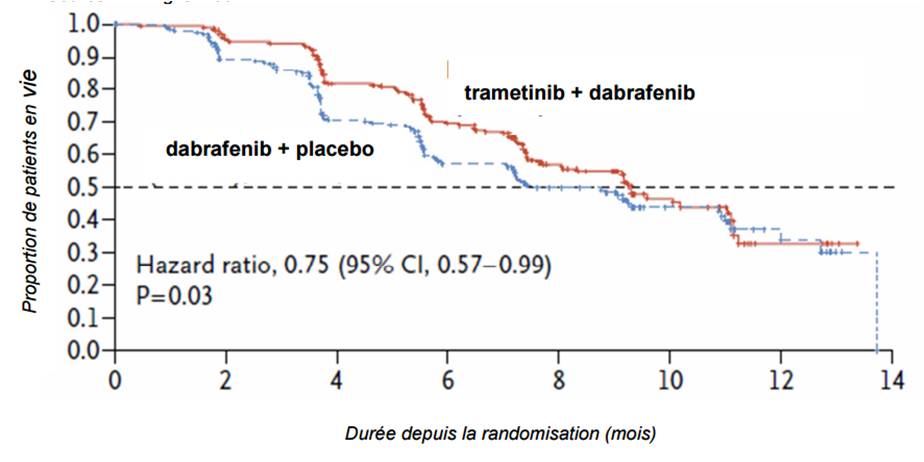
-
- Sur le critère de jugement secondaire, la médiane de survie globale a été estimée à 25,1 mois dans le groupe tramétinib + dabrafénib versus 18,7 mois dans le groupe dabrafénib (HR = 0,71 ; IC95% = [0,55-0,92] ; p = 0,011) [Cf. Figure 2].
Figure 2 - Courbes de survie globale (Kaplan-Meier) d'après le rapport d'étude clinique
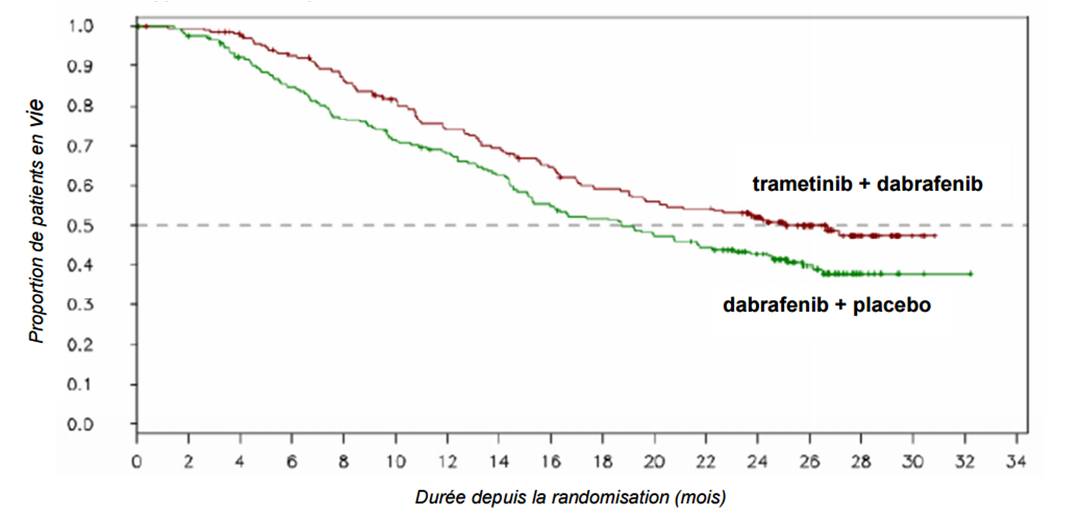
Selon la CT "le choix de la survie globale comme critère de jugement principal eut été préférable pour évaluer précisément la bénéfice clinique apporté par l'association trametinib + dabrafenib".
- L'étude COMBI-v (MEK116513) menée en ouvert versus vémurafénib (ZELBORAF) en monothérapie auprès de 704 patients :
- La médiane de survie globale (critère de jugement principal) n'a pas été atteinte dans le groupe tramétinib + dabrafénib et a été estimée à 17,2 mois dans le groupe vemurafenib (25,6 mois versus 18,0 mois lors de l'analyse finale).
- Le pourcentage de patients décédés a été de 28 % (100/352) dans le groupe tramétinib + dabrafénib et de 35 % (122/352) dans le groupe vemurafénib (HR = 0,69 ; IC95% = [0,53-0,89] ; p = 0,005, soit p < 0,0214 prévue dans cette analyse intermédiaire).
- La médiane de survie sans progression (progression de la maladie ou décès) a été de 11,4 mois dans le groupe tramétinib + dabrafénib versus 7,4 mois dans le groupe vémurafenib (HR = 0,56 ; IC95% = [0,46-0,69]).
En termes de tolérance, les effets indésirables les plus fréquemment observés au cours de ces études avec l'association tramétinib + dabrafénib versus dabrafénib en monothérapie sont présentés dans le tableau I.
Tableau I - Effets indésirables les plus fréquemment observés avec l'association tramétinib + dabrafénib versus dabrafénib ou vémurafénib
| Effets indésirables | tramétinib + dabrafénib | dabrafénib ou vémurafénib |
| Fièvre | 53 à 57 % | 21 à 33 % |
| Nausées | 34 à 35 % | 27 à 36 % |
| Vomissements | 25 à 29 % | 14 à 15 % |
| Hypertension | 25 à 26 % | 16 à 24 % |
| Diarrhées | 30 à 32 % | 16 à 38 % |
| Frissons | 31% | 8 à 17% |
Les événements indésirables cutanés ont été en revanche moins fréquemment observés avec l'association tramétinib + dabrafénib versus dabrafénib (Cf. Tableau II).
Tableau II - Effets indésirables cutanés observés avec l'association trametinib + dabrafenib versus dabrafénib ou vemurafenib
| Effets indésirables cutanés | trametinib + dabrafenib | dabrafénib ou vemurafenib |
| Hyperkératoses | 4 à 7 % | 25 à 35 % |
| Alopécie | 6 à 9 % | 28 à 39% |
| Syndromes mains-pieds (érythrodyesthésies et kératodermies) | 4 à 7 % | 25 à 30 % |
| Papillomes cutanés | 2 % | 22 à 23 % |
| Réactions de photosensibilité | 4 % | 22 % |
| Carcinomes épidermoïdes | 1 % | 5 à 10 % |
| Carcinome basocellulaire | 3 % | 6 % |
Au vu des données disponibles, la CT a considéré que MEKINIST apporte un service médical rendu (SMR) important dans son indication d'AMM en association au dabrafenib et une amélioration du SMR de niveau III (ASMR modéré) dans la stratégie thérapeutique du mélanome non résécable ou métastatique muté B-RAF V600.
MEKINIST en association au dabrafénib n'est pas recommandé en 2e ligne de traitement chez les patients ayant déjà reçu un inhibiteur de B-RAF en monothérapie en 1re ligne de traitement : il s'agit d'un traitement de 1re intention dans la prise en charge du mélanome non résécable ou métatatique porteur de la mutation B-RAF V600.
MEKINIST en pratique
Le traitement par MEKINIST doit être initié sous la responsabilité d'un médecin expérimenté dans l'utilisation des traitements anticancéreux.
Avant de débuter un traitement par tramétinib seul ou associé au dabrafénib, la présence d'une mutation B-RAF V600 doit être confirmée par un test validé.
Seuls les patients présentant cette mutation seront traités avec MEKINIST.
- Une prise sans nourriture et à horaire régulier
Le tramétinib doit être pris sans nourriture, au moins 1 heure avant ou 2 heures après un repas.
Il est recommandé de prendre la dose de tramétinib approximativement à la même heure chaque jour.
Lorsqu'elle est associée au dabrafénib, la prise de tramétinib doit coïncider avec la prise du dabrafénib (prise du matin ou du soir).
Il est recommandé de prendre la dose de tramétinib approximativement à la même heure chaque jour.
Lorsqu'elle est associée au dabrafénib, la prise de tramétinib doit coïncider avec la prise du dabrafénib (prise du matin ou du soir).
- Une posologie identique en monothérapie ou en association au dabrafénib
Que le tramétinib soit utilisé en monothérapie ou en association au dabrafénib, la dose recommandée est de 2 mg 1 fois par jour.
La dose recommandée de dabrafénib, quand il est utilisé en association au tramétinib, est de 150 mg 2 fois par jour.
Le traitement doit être poursuivi tant que le patient en tire un bénéfice ou jusqu'à la survenue d'une toxicité inacceptable.
Une adaptation posologique du tramétinib et, en cas d'association, du dabrafénib, peut être nécessaire en présence d'effets secondaires.
Selon la sévérité des événements indésirables, une interruption temporaire du traitement ou un arrêt définitif doivent être envisagés.
La dose recommandée de dabrafénib, quand il est utilisé en association au tramétinib, est de 150 mg 2 fois par jour.
Le traitement doit être poursuivi tant que le patient en tire un bénéfice ou jusqu'à la survenue d'une toxicité inacceptable.
Une adaptation posologique du tramétinib et, en cas d'association, du dabrafénib, peut être nécessaire en présence d'effets secondaires.
Selon la sévérité des événements indésirables, une interruption temporaire du traitement ou un arrêt définitif doivent être envisagés.
- Une surveillance particulière et supplémentaire
Chez tous les patients, la fraction d'éjection du ventricule gauche (FEVG) doit être évaluée avant l'instauration du traitement, un mois après l'instauration du traitement, puis environ tous les 3 mois durant tout le traitement.
La pression artérielle doit être mesurée à l'instauration du traitement et surveillée pendant le traitement par tramétinib. Une hypertension artérielle doit être prise en charge par un traitement standard si nécessaire.
Comme pour tous les médicaments dont les autorités sanitaires souhaitent pouvoir disposer de données complémentaires, MEKINIST fait l'objet d'une surveillance supplémentaire qui permettra l'identification rapide de nouvelles informations relatives à la sécurité (Cf. Infos Pratiques VIDAL - Médicaments sous surveillance renforcée).
Dans ce contexte, les professionnels de santé sont invités à déclarer tout effet indésirable suspecté (Cf. ANSM - Comment déclarer un effet indésirable ?).
Conseils aux patients
Avant ouverture, MEKINIST est à conserver au réfrigérateur, entre 2 °C et 8 °C, dans l'emballage d'origine, à l'abri de la lumière et de l'humidité.
Une fois ouvert, le flacon peut être conservé 30 jours à une température ne dépassant pas 30 °C.
Les modalités de prise doivent être rappelées aux patients, à savoir une prise quotidienne à horaire régulier, sans nourriture.
Enfin, les patients doivent être informés qu'ils doivent consulter leur médecinen cas de signes d'atteinte pulmonaire (toux, dyspnée, etc.), de troubles de la vue, de signes de thrombose veineuse ou d'embolie pulmonaire (essoufflement, douleur thoracique, gonflement d'un membre).
Identité administrative
La pression artérielle doit être mesurée à l'instauration du traitement et surveillée pendant le traitement par tramétinib. Une hypertension artérielle doit être prise en charge par un traitement standard si nécessaire.
Comme pour tous les médicaments dont les autorités sanitaires souhaitent pouvoir disposer de données complémentaires, MEKINIST fait l'objet d'une surveillance supplémentaire qui permettra l'identification rapide de nouvelles informations relatives à la sécurité (Cf. Infos Pratiques VIDAL - Médicaments sous surveillance renforcée).
Dans ce contexte, les professionnels de santé sont invités à déclarer tout effet indésirable suspecté (Cf. ANSM - Comment déclarer un effet indésirable ?).
Conseils aux patients
Avant ouverture, MEKINIST est à conserver au réfrigérateur, entre 2 °C et 8 °C, dans l'emballage d'origine, à l'abri de la lumière et de l'humidité.
Une fois ouvert, le flacon peut être conservé 30 jours à une température ne dépassant pas 30 °C.
Les modalités de prise doivent être rappelées aux patients, à savoir une prise quotidienne à horaire régulier, sans nourriture.
Enfin, les patients doivent être informés qu'ils doivent consulter leur médecinen cas de signes d'atteinte pulmonaire (toux, dyspnée, etc.), de troubles de la vue, de signes de thrombose veineuse ou d'embolie pulmonaire (essoufflement, douleur thoracique, gonflement d'un membre).
Identité administrative
- Liste I
- Prescription hospitalière réservée aux spécialistes en oncologie ou aux médecins compétents en cancérologie
- Surveillance particulière pendant le traitement
- Remboursable à 100 % uniquement en association au dabrafénib
- MEKINIST 0,5 mg, flacon de 30, CIP 3400927944352, prix public TTC = 1 498,83 euros (Journal officiel du 22 novembre 2016 - texte 11)
- MEKINIST 2 mg, flacon de 30, CIP 3400927944703, prix public TTC = 5 643,29 euros (Journal officiel du 22 novembre 2016 - texte 12)
- Agrément aux collectivités uniquement en association au dabrafénib
- Laboratoire Novartis Pharma
Pour aller plus loin
Avis de la Commission de la Transparence (HAS, 20 janvier 2016)
Long GV, Stroyakovskiy D, Gogas H, Levchenko E, de Braud F, Larkin J et al. Combined BRAF and MEK inhibition versus BRAF inhibition alone in melanoma. N Engl J Med. 2014 ; 371 : 1877-88
Pour aller plus loin
Consultez les monographies VIDAL
Pour recevoir gratuitement toute l’actualité par mail Je m'abonne !

 7 minutes
7 minutes Ajouter un commentaire
Ajouter un commentaire


Commentaires
Cliquez ici pour revenir à l'accueil.