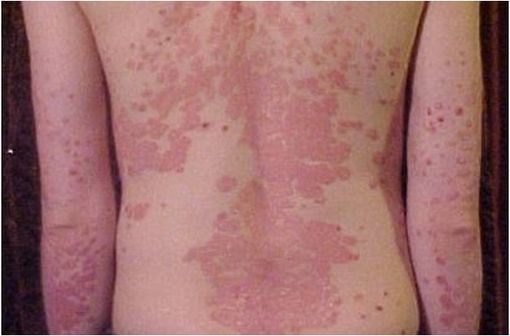
Lésions de psoriasis en plaques sévère localisées au dos d'une adolescente (illustration @Dr James Heilman, sur Wikimedia).
Un périmètre de remboursement élargi mais restreint par rapport à l'indication d'AMM
La prise en charge de STELARA solution injectable SC (ustekinumab) est étendue au traitement du psoriasis en plaques de l'adolescent, à partir de 12 ans, mais limitée aux formes chroniques sévères définies par :
- un échec à au moins 2 traitements parmi les traitements systémiques non biologiques et la photothérapie ;
- et une forme étendue et/ou un retentissement psychosocial important.
L'extension d'indication de STELARA en pédiatrie a été octroyée en juin 2015 dans le traitement du psoriasis en plaques modéré à sévère chez l'adolescent âgé de 12 ans et plus, en seconde intention après échec des traitements systémiques non biologiques ou de la photothérapie.
Mais, comme chez l'adulte, la prise en charge de cet inhibiteur d'interleukines IL-12/IL-23 dans la population pédiatrique ne couvre pas le traitement de la forme modérée du psoriasis en plaques chronique.
STELARA supérieur au placebo chez l'adolescent en termes de score PGA
Cette extension du périmètre remboursement de STELARA chez l'adolescent fait suite à l'avis de la Commission de la transparence rendu en juin 2016.
La Commission s'est notamment appuyée sur une étude de phase III versus placebo randomisée en double aveugle (étude Cadmus) conduite chez 110 adolescents âgés de 12 à 17 ans ayant un psoriasis modéré à sévère en échec aux traitements locaux.
Le critère principal d'efficacité était le score PGA (Cf. Encadré 1).
Encadré 1 - Score Physician Global Assesment (PGA)
| Evaluation globale par le médecin de la sévérité de la maladie comprenant 6 niveaux de sévérité. Il renseigne sur l'évaluation globale du psoriasis à un moment donné : les lésions sont classées en prenant en compte leur durée, leur ampleur et l'érythème. Plus les scores sont élevés plus le psoriasis est considéré comme sévère. Les niveaux de sévérité du PGA sont : 0 = « blanchi » ou « clair » 1 = « minimal » 2 = « léger » 3 = « modéré » 4 = « marqué » 5 = « sévère » |
Sur ce critère principal, l'ustekinumab a été supérieur au placebo à la semaine 12 avec 69,4 % de scores PGA 0 ou 1 versus 5,4 % (p < 0,001).
La Commission fait remarquer qu'"on ne dispose ni de données spécifiques chez l'adolescent en échec de traitements systémiques [NDLR : ce qui correspond pourtant à l'indication de l'AMM de STELARA], ni de données versus étanercept", autre anti-TNF alpha ayant une indication chez l'adolescent atteint de psoriasis en plaques au moment de l'évaluation.
Le profil de tolérance de STELARA chez l'adolescent a été similaire à celui observé chez l'adulte.
Les effets indésirables les plus souvent rapportés avec l'ustekinumab ont été des rhinopharyngites, des céphalées et des infections des voies respiratoires supérieures.
Un périmètre de remboursement conforme à la place de STELARA dans la stratégie thérapeutique du psoriasis de l'adolescent
Selon la Commission de la transparence, STELARA est, chez l'adolescent à partir de 12 ans, un traitement de 2e intention dans la prise en charge du psoriasis en plaques chronique sévère.
Son service médical rendu (SMR) est jugé important dans cette indication mais sans amélioration (ASMR V).
A noter que les traitements actuels du psoriasis en plaques n'entraînant pas la guérison définitive de l'affection, la stratégie thérapeutique est rotationnelle, en raison notamment des phénomènes d'échappement.
STELARA chez l'adolescent : en pratique
Quelle que soit l'indication concernée, compte tenu du risque potentiel rare mais grave de réactions systémiques à l'injection, incluant des réactions anaphylactiques, avec l'ustékinumab sous-cutané mais aussi avec les autres traitements de fond biologiques, il est conseillé de réaliser la 1re injection sous-cutanée de STELARA dans une structure de soins adaptée.
La posologie est calculée en fonction du poids corporel du patient, à savoir :
- poids inférieur à 60 kg : 0,75 mg/kg
- entre 60 et 100 kg : 45 mg
- plus de 100 kg : 90 mg
Une prescription restreinte pour un médicament d'exception
STELARA est un médicament d'exception dont la prescription doit être conforme à la fiche d'information thérapeutique.
La prescription initiale de STELARA est hospitalière et annuelle.
La prescription initiale et le renouvellement sont réservés aux spécialistes en dermatologie, en médecine interne ou en rhumatologie.
Sous couvert du respect de ces conditions de prescription, STELARA est pris en charge au taux de 65 %.
Son prix de vente s'élève à 2608,44 € (hors honoraire de dispensation) quelle que soit la présentation, en flacon à 45 mg et en seringues préremplies à 45 mg et à 90 mg.
Pour aller plus loin
Arrêté du 6 juillet 2016 modifiant la liste des spécialités pharmaceutiques remboursables aux assurés sociaux - Fiche d'information thérapeutique (Journal officiel du 12 juillet 2016 - texte 21)
Arrêté du 6 juillet 2016 modifiant la liste des spécialités pharmaceutiques agréées à l'usage des collectivités et divers services publics (Journal officiel du 12 juillet 2016 - texte 21)
Avis de la Commission de la Transparence du 22 juin 2016 (HAS, mise en ligne le 6 juillet 2016)
Pour aller plus loin
Consultez les monographies VIDAL
Sources
Pour recevoir gratuitement toute l’actualité par mail Je m'abonne !

 4 minutes
4 minutes Ajouter un commentaire
Ajouter un commentaire




Les commentaires sont momentanément désactivés
La publication de commentaires est momentanément indisponible.