Carcinome pulmonaire à grandes cellules, un sous-type de carcinome pulmonaire non à petites cellules (illustration @AFIP, sur Wikimedia).
OPDIVO 10 mg/ml solution à diluer pour perfusion dispose désormais d'une indication dans le traitement de seconde ligne du cancer bronchique non à petites cellules (CBNPC) de type épidermoïde localement avancé ou métastatique.
Cette nouvelle indication résulte de la fusion des AMM (autorisation de mise sur le marché) des deux spécialités de nivolumab, OPDIVO et NIVOLUMAB BMS 10 mg/ml.
OPDIVO disposait déjà d'une AMM en monothérapie dans le traitement des patients adultes atteints d'un mélanome avancé (non résécable ou métastatique)
NIVOLUMAB BMS et OPDIVO : désormais fusionnés
- NIVOLUMAB BMS : précédemment disponible sous ATU mais pas commercialisé
Cette spécialité bénéficiait d'une autorisation temporaire d'utilisation (ATU) dans les indications suivantes :
- Traitement des patients adultes (>= 18 ans) atteints d'un mélanome non résécable (stade III) ou métastatique (stade IV) :
- chez les patients ne présentant pas de mutation BRAFV600 : traitement de 1re ligne en cas de contre-indication à l'utilisation de l'ipilimumab ou d'antécédents gastro-intestinaux ne permettant pas le recours à l'ipilimumab, ou après échec d'ipilimumab ;
- chez les patients présentant une mutation BRAFV600 ayant échappé à un inhibiteur BRAF (dabrafénib, vémurafénib).
- Traitement en monothérapie des patients adultes (>= 18 ans) atteints d'un cancer bronchique non à petites cellules de type épidermoïde de stade IIIb ou IV après échec d'au moins une ligne de traitement à base de sels de platine.
- OPDIVO et NIVOLUMAB BMS : fusion des AMM
Cette spécialité a été commercialisée en France en septembre 2015 (voir notre article du 2 juillet 2015).
En novembre 2015, les AMM des spécialités OPDIVO et NIVOLUMAB BMS ont été fusionnées sous le nom de la seule et même spécialité dénommée OPDIVO, de telle sorte que cette spécialité unique dispose de l'indication dans le traitement du mélanome et de l'indication dans le traitement du cancer bronchique non à petites cellules.
OPDIVO 10 mg/ml est désormais la seule spécialité de nivolumab commercialisée en France.
Tolérance et efficacité du nivolumab dans le cancer bronchique
- L'étude pivot de phase III versus docétaxel
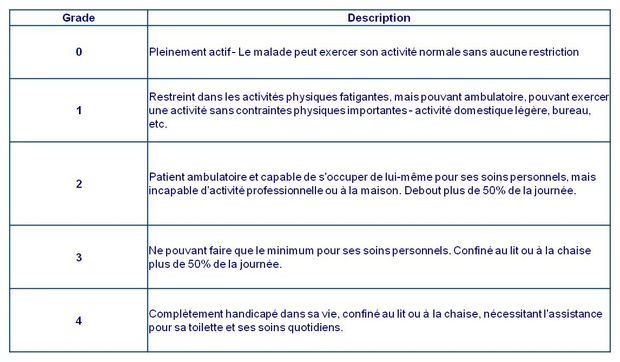
L'étude a inclus des patients adultes (n = 272) dont la maladie avait progressé pendant ou après une première ligne de chimiothérapie à base d'un doublet de sels de platine et avec un statut de performance ECOG de 0 ou 1 (voir Figure 1).
Figure 1 - Indice de performance ECOG
Les patients ont été répartis en 2 groupes :
- Groupe recevant du nivolumab (n = 135) à la posologie de 3 mg/kg administré par voie intraveineuse (IV) sur 60 minutes, toutes les 2 semaines.
- Groupe recevant du docétaxel (n = 137) à la posologie de 75 mg/m2 administré par voie IV toutes les 3 semaines.
Le traitement était poursuivi tant qu'un bénéfice clinique était observé ou jusqu'à ce que le patient ne puisse plus tolérer le traitement.
Le critère d'efficacité principal était la survie globale (SG).
Les résultats de cette étude ont montré une réduction du risque de décès de 41 % avec un taux de survie à 1 an de 42 % pour le nivolumab (42,1 %, [IC 95 % : 33,7 - 50,3]) par rapport à 24 % (23,7 %, [IC 95 % : 16,9 - 31,1]) pour le docétaxel (HR : 0,59, [96,8 % IC : 0,43 - 0,81], p = 0,0002).
La durée médiane de survie globale était de 9,2 mois pour le nivolumab par rapport à 6 mois pour le docétaxel.
Concernant les critères secondaires d'efficacité :
- le taux d'amélioration des symptômes liés à la maladie, mesuré par le score LCSS (Lung Cancer Symptom Score), était similaire entre le bras nivolumab (18,5 %) et le bras docétaxel (21,2 %) ;
- la moyenne EQ-VAS* a augmenté au fil du temps pour les deux groupes de traitement, suggérant un meilleur état de santé global pour les patients restant sous traitement.
*L'EQ-VAS (échelle visuelle analogique) évalue la qualité de vie liée à la santé (QVLS) sur les critères mobilité, autonomie, activités courantes, douleur/gêne physique, et anxiété/dépression ; elle est graduée de 0 (mauvaise QVLS) à 100 (meilleure QVLS).
En termes de tolérance, les effets indésirables liés au traitement, y compris les toxicités hématologiques ou non-hématologiques, ont été moins fréquents dans l'étude de Brahmer and al. avec le nivolumab (tout grade : 58 %, grade 3-4 : 6,9 %, grade 5 : aucun) qu'avec docétaxel (tout grade : 86 %, grade 3-4 : 55 %, grade 5 : 2,3 %).
Ils ont entraîné l'arrêt du traitement chez 3,1 % des patients du groupe nivolumab, le plus souvent à cause d'une pneumopathie inflammatoire (1,5 %), versus 10,1 % pour le docétaxel, le plus souvent en raison d'une neuropathie périphérique (3,1 %).
Les effets secondaires rapportés au traitement les plus fréquents ont été, pour le nivolumab, la fatigue (16 %), la baisse d'appétit (11 %) et l'asthénie (10 %) et, pour le docétaxel, la neutropénie (33 %), l'alopécie (22 %) et la nausée (23 %).
- Etude de phase II : une survie globale médiane de 8,21 mois
- un taux de réponse objective confirmée (critère d'évaluation principal) de 14,5 % (IC 95 % : 8,7 - 22,2 %),
- une survie globale médiane de 8,21 mois (IC 95 % : 6,05 à 10,9 mois),
- et une survie sans progression médiane de 1,87 mois (IC 95 % : 1,77 à 3,15 mois).
Le taux de survie estimé à 1 an était de 41 %.
OPDIVO : en pratique
OPDIVO est un médicament réservé à l'usage hospitalier.
Sa prescription est réservée aux spécialistes en oncologie ou aux médecins compétents en cancérologie.
- Une posologie commune aux deux indications
Dans ses deux indications, la dose recommandée d'OPDIVO est de 3 mg/kg, administrée en perfusion intraveineuse de 60 minutes toutes les 2 semaines.
Le traitement doit être poursuivi tant qu'un bénéfice clinique est observé ou jusqu'à ce que le patient ne puisse plus tolérer le traitement.
Les augmentations ou diminutions de doses ne sont pas recommandées. Selon la tolérance individuelle et la tolérabilité au traitement, des administrations différées ou des interruptions de traitement peuvent être nécessaires.
- Effets indésirables d'origine immunologique : surveillance particulière
Le traitement doit être définitivement arrêté en cas d'effet indésirable grave récurrent d'origine immunologique, et pour tout effet indésirable d'origine immunologique pouvant menacer le pronostic vital.
- Une carte patient pour informer des risques liés au nivolumab
Lors de la consultation, les prescripteurs doivent informer leurs patients sur les risques liés au traitement par nivolumab et leur remettre la Carte d'Alerte Patient.
Cette carte comporte :
- la liste des risques que le médicament est susceptible d'augmenter,
- les signes et symptômes d'un problème de tolérance et le moment où l'attention d'un professionnel de santé est requise,
- et les coordonnées du médecin prescripteur.
Identité administrative
- Liste I
- Médicament réservé à l'usage hospitalier
- Prescription réservée aux spécialistes en oncologie ou aux médecins compétents en cancérologie
- Surveillance particulière pendant le traitement
- Flacon de 4 ml, CIP 3400955005797
- Flacon de 10 ml, CIP 3400955005803
- Prise en charge selon les conditions définies à l'article L.162-16-5-2 du code de la Sécurité sociale (demande d'agrément aux collectivités en cours)
- Laboratoire Bristol-Myers Squibb
EDIT du 2 janvier 2017 :
Agrément aux collectivités et inscription sur la liste des spécialités prises en charge en sus des GHS :
- en monothérapie dans le traitement des patients adultes atteints d'un mélanome avancé (non résécable ou métastatique) ;
- traitement des patients adultes atteints d'un cancer bronchique non à petites cellules (CBNPC) de type épidermoïde localement avancé ou métastatique après une chimiothérapie antérieure (NB : pour le CBNPC de type non épidermoïde, la prise en charge d'OPDIVO est prolongée au titre de relais d'ATU) ;
- traitement du cancer du rein à cellules claires ou comportant un contingent de cellules claires au stade avancé après échec d'un traitement antérieur par anti-VEGF.
Flacon de 4 mL, UCD 3400894094692, prix de vente HT aux établissements de santé = 527,582 euros
FIN EDIT/
EDIT du 7 mars 2017 :
Agrément aux collectivités et inscription sur la liste des spécialités prises en charge en sus des GHS dans le traitement des patients adultes atteints d'un cancer bronchique non à petites cellules (CBNPC) de type non épidermoïde localement avancé ou métastatique après une chimiothérapie antérieure uniquement chez les patients en bon état général (ECOG 0 ou 1).
FIN EDIT/
Pour aller plus loin
Résumé de l'avis du CHMP post-autorisation (24 septembre 2015)
Plan de gestion des risques (PGR) europée de NIVOLUMAB BMS (en anglais)
Guide de prise en charge des effets indésirables d'origine immunologique
Carte d'Alerte Patient
EDIT du 2 janvier 2017 : publication au Journal officiel
Arrêté du 22 décembre 2016 modifiant la liste des spécialités pharmaceutiques agréées à l'usage des collectivités et divers services publics (Journal officiel du 27 décembre 2016 - texte 26)
Arrêté du 22 décembre 2016 modifiant la liste des spécialités pharmaceutiques prises en charge en sus des prestations d'hospitalisation mentionnée à l'article L. 162-22-7 du code de la sécurité sociale (Journal officiel du 27 décembre 2016 - texte 27)
FIN EDIT/
EDIT du 7 mars 2017 : publication au Journal officiel
Arrêté du 3 mars 2017 modifiant la liste des spécialités pharmaceutiques agréées à l'usage des collectivités et divers services publics (Journal officiel du 4 mars 2017 - texte 24)
Arrêté du 3 mars 2017 modifiant la liste des spécialités pharmaceutiques prises en charge en sus des prestations d'hospitalisation mentionnée à l'article L. 162-22-7 du code de la sécurité sociale (Journal officiel du 4 mars 2017 - texte 23)
FIN EDIT/
Sur Vidal.fr
OPDIVO (nivolumab) : nouveau principe actif dans la prise en charge du mélanome avancé (2 juillet 2015)
Pour aller plus loin
Consultez les monographies VIDAL
Consultez les VIDAL Recos
Sources
Pour recevoir gratuitement toute l’actualité par mail Je m'abonne !

 8 minutes
8 minutes Ajouter un commentaire
Ajouter un commentaire




Les commentaires sont momentanément désactivés
La publication de commentaires est momentanément indisponible.