Représentation en 3D d'une immunoglobuline (illustration).
Résumé :
La gamme à base d'immunoglobuline humaine normale GAMUNEX 100 mg/mL solution pour perfusion bénéficie d'une extension de son agrément aux collectivités et de sa prise en charge en rétrocession dans l'immunomodulation chez l'adulte (18 ans et plus) en cas de poussées myasthéniques aiguës sévères.
La gamme à base d'immunoglobuline humaine normale GAMUNEX 100 mg/mL solution pour perfusion bénéficie d'une extension de son agrément aux collectivités et de sa prise en charge en rétrocession dans l'immunomodulation chez l'adulte (18 ans et plus) en cas de poussées myasthéniques aiguës sévères.
La spécialité hospitalière GAMUNEX 100 mg/mL solution pour perfusion à base d'immunoglobuline humaine normale bénéficie d'une extension de prise en charge (agrément aux collectivités et rétrocession) dans l'indication suivante :
- immunomodulation chez les adultes âgés de 18 ans et plus en cas de poussées myasthéniques aiguës sévères (cf. Encadré 1).
Encadré 1 - Indications thérapeutiques de GAMUNEX
Traitement de substitution chez les adultes, les enfants et les adolescents (âgés de 0 à 18 ans) :
Immunomodulation chez les adultes âgés de 18 ans et plus en cas de :
|
Cette extension de prise en charge s'applique à l'ensemble des présentations de GAMUNEX :
- flacon de 10 mL, CIP 3400930169599 (non commercialisé)
- flacon de 50 mL, CIP 3400930169605
- flacon de 100 mL, CIP 3400930169612
- flacon de 200 mL, CIP 3400930169629
- flacon de 400 mL, CIP 3400930169636
Évaluation médico-économique : SMR important, ASMR V
L'évaluation de l'efficacité et de la tolérance de GAMUNEX (immunoglobuline humaine normale) dans les poussées myasthéniques aiguës sévères repose sur 5 études de phase III fournies par le laboratoire, dont l'étude GTI1305 (1) est la plus récente.
Les données issues de cette étude ont été analysées par la Commission de la Transparence (CT) dans l'avis du 6 janvier 2021.
L'étude GTI1305 est une étude de phase III multicentrique, prospective, en ouvert, non contrôlée, réalisée chez 49 patients ayant des poussées aiguës de myasthénie et dont les objectifs étaient d'évaluer :
- l'efficacité de GAMUNEX en termes de variation du score QMG13 (Quantitative myasthenia gravis score) entre J0 et J14 (critère de jugement principal). Le score QMG moyen a été de 22,0 (4,6) à l'inclusion et de 15,6 (5,14) à J14, soit une variation moyenne de -6,4 (± 5,15) (IC 95% = [- 7,957 ; - 4,787]) ;
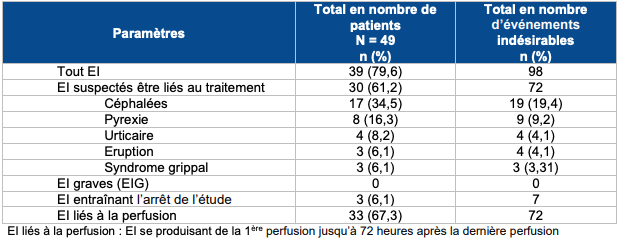
- la tolérance de GAMUNEX, les effets indésirables les plus fréquents (> 10 %) ayant été une céphalée (38,8 % des patients) et une pyrexie (16,3 % des patients) [cf. Tableau I].
Tableau I - Résumé des événements indésirables dans l'étude GTI1305 (population de tolérance) [source : avis de la CT du 6 janvier 2021 sur GAMUNEX]
Les risques importants, identifiés ou potentiels, selon le plan de gestion des risques (PGR) de GAMUNEX, sont listés dans le Tableau II ci-dessous.
Tableau II - Résumé des risques du PGR de GAMUNEX (tel que cité dans le PSUR établi pour la période allant du 1er juin 2016 au 31 mai 2017)

À l'issue de cette évaluation et sur la base des données disponibles, la CT a attribué un service médical rendu (SMR) important à GAMUNEX, sans amélioration du SMR (ASMR V), compte tenu de l'absence de données comparatives versus TEGELINE, seule autre immunoglobuline humaine normale administrée par voie intraveineuse ayant une AMM, ou versus les autres spécialités à base d'immunoglobuline humaine, dans le traitement des poussées myasthéniques aiguës sévères.
Dans cette indication, la CT considère que GAMUNEX est une alternative thérapeutique supplémentaire aux autres spécialités à base d'immunoglobulines humaines.
Pour aller plus loin
Arrêté du 9 juin 2021 relatif aux conditions de prise en charge de spécialités pharmaceutiques disposant d'une autorisation de mise sur le marché inscrites sur la liste visée à l'article L. 5126-6 du code de la santé publique - GAMUNEX (Journal officiel du 15 juin 2021 - texte 15)
Arrêté du 9 juin 2021 modifiant la liste des spécialités pharmaceutiques agréées à l'usage des collectivités et divers services publics - GAMUNEX (Journal officiel du 15 juin 2021 - texte 15)
Commission de la Transparence - GAMUNEX (HAS, 6 janvier 2021)
L'étude pivot GTI1305
(1) Karelis G, Balasa R et al. A Phase 3 Multicenter, Prospective, Open-Label Efficacy and Safety Study of Immune Globulin (Human) 10% Caprylate/Chromatography Purified in Patients with Myasthenia Gravis Exacerbations. Eur Neurol. 2019 ; 81: 223-30.
Pour aller plus loin
Consultez les monographies VIDAL
Pour recevoir gratuitement toute l’actualité par mail Je m'abonne !

 3 minutes
3 minutes Ajouter un commentaire
Ajouter un commentaire





Les commentaires sont momentanément désactivés
La publication de commentaires est momentanément indisponible.