Vaccins contre la COVID-19 : des effets indésirables surveillés à la loupe (illustration).
Suite à la survenue de cas d'évènements thromboemboliques et de troubles de la coagulation dans plusieurs pays européens chez des sujets ayant reçu le vaccin ASTRAZENECA (dont un décès en Autriche), l'ANSM a décidé de suspendre l'utilisation du vaccin ASTRAZENECA à compter du 15 mars 2021 et jusqu'à publication des conclusions de l'EMA attendues le 18 mars 2021.
Cette décision française est prise à titre de précaution ; aucun élément ne permet à ce jour d'établir le lien de causalité entre le vaccin ASTRAZENECA et la survenue d'événements thromboemboliques.
En Union européenne, plusieurs états membres (dont l'Autriche, l'Allemagne, le Danemark, l'Islande, la Norvège, l'Italie) ont décidé, comme la France, de suspendre la vaccination, soit avec le lot ABV5300 du vaccin ASTRAZENECA ou un autre lot, soit avec tous les lots de ce vaccin.
Événéments thromboemboliques et vaccin ASTRAZENECA : les données françaises au 15 mars
En France, "très peu de cas d'événements thromboembolique ont été signalés et aucun décès n'a été constaté dans le cadre de la surveillance nationale", indique la Direction générale de la Santé (DGS) dans un message adressé aux professionnels de santé le 15 mars, suite à la suspension du vaccin ASTRAZENECA.
Dans le quatrième rapport hebdomadaire de surveillance du vaccin ASTRAZENECA portant sur la période du 26 février au 4 mars 2021, aucun cas de thrombose ni de thrombopénie n'a été rapporté avec ce vaccin (cf. Encadré 1), mais 3 cas graves d'ordre hématologiques ont été analysés :
- 1 cas de thrombose multiple (cérébrale, portale et pulmonaire) dans un contexte de coagulation intravasculaire disséminée (CIVD). Le patient a reçu une dose du lot ABV3025. Son état de santé est en cours d'amélioration ;
- 2 cas de lymphadénopathies.
Encadré 1 - Cas d'événements thrombo-emboliques signalés non investigués (embolie pulmonaire, thrombose) rapportés en France (données cumulées au 4 mars 2021)
|
État des lieux des effets indésirables associés au lot ABV5300, en France
En Autriche ainsi que dans d'autres pays européens, seul le lot ABV5300 a initialement été suspendu, suite au décès d'un patient et à un cas d'embolie pulmonaire survenus après l'administration d'une dose de ce lot.
Ce lot a été distribué dans 17 pays en Europe. La France en a reçu 316 800 doses depuis le 9 février 2021 et près de la moitié de ces doses ont déjà été administrées.
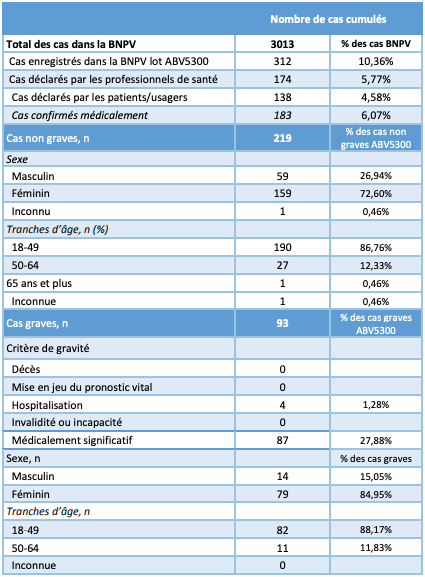
Au total, 183 cas d'effets indésirables médicalement confirmés et associés au lot ABV5300 ont été enregistrés en France depuis le début de la vaccination par le vaccin AstraZeneca (cf. Tableau I).
Dans un communiqué du 13 mars 2021, l'ANSM précise que, parmi ces cas, aucun décès, ni situation de mise en jeu du pronostic vital, ni cas de thrombose ou de thrombopénie, n'a été mis en évidence en France.
En revanche, l'injection d'une dose issue du lot ABV5300 est associée (selon le quatrième rapport de surveillance - du 26 février au 4 mars 2021) aux signalements suivants :
- un cas de cyanose des extrémités avec désaturation à 86 %, vomissements et fièvre (effets vasculaires) ;
- un cas d'hypoxie suivie, le lendemain, de malaise avec désaturation et hypertension (effets respiratoires, thoraciques et médiastinaux).
Tableau I - Extraction de la base nationale de pharmacovigilance (BNPV) du 08/03/2021 concernant le lot ABV5300
L'avenir du vaccin ASTRAZENECA en attente des conclusions européennes
L'EMA prévoit de rendre ses conclusions jeudi 18 mars.
Selon les premières informations recueillies et analyses communiquées, l'EMA indique que (communiqué du 15 mars 2021) :
- le lien de causalité entre les événements thrombo-emboliques parfois d'issue fatale et l'injection du vaccin ASTRAZENECA n'est pas établi ;
- il n'est pas identifié de surrisque d'événements thrombo-emboliques avec le vaccin ASTRAZENECA, par rapport à la population générale. Au 10 mars, le nombre d'événements thrombo-emboliques enregistré dans la base européenne de pharmacovigilance Eudravigilance s'élevait à 30, pour 5 millions de sujets vaccinés avec le vaccin ASTRAZENECA en Europe ;
- le rapport bénéfice/risque de ce vaccin reste positif.
À l'issue de la réévaluation européenne, la France révisera sa position vis-à-vis de la place de ce vaccin dans la stratégie vaccinale française.
Rassurer les personnes déjà vaccinées par le vaccin ASTRAZENECA
En France, le nombre de Français vaccinés avec le vaccin ASTRAZENECA atteignait 1 359 051 le 15 mars 2021 (source covidtracker, 14 mars 2021).
Dans son message du 15 mars 2021, la DGS souligne que "les personnes déjà vaccinées n'ont aucune démarche spécifique à accomplir."
Quel que soit le vaccin, tout signe ou symptôme évoquant un effet indésirable doit faire l'objet d'un signalement au médecin vaccinateur ou au professionnel de santé ayant réalisé la vaccination.
Vaccin AstraZeneca : analyse des autres données de pharmacovigilance à partir du quatrième rapport de surveillance
Le quatrième rapport de surveillance du vaccin ASTRAZENECA porte sur les données de pharmacovigilance françaises recueillies en quatrième semaine d'utilisation, soit du 26 février au 4 mars 2021.
Depuis le début de la vaccination avec ce vaccin, utilisé majoritairement en ville, le profil de sécurité est dominé par des syndromes pseudo-grippaux, souvent de forte intensité (fièvre élevée, courbatures, céphalées).
Au total, 3 013 cas d'effets indésirables ont été analysés sur 454 545 injections réalisées au 4 mars 2021.
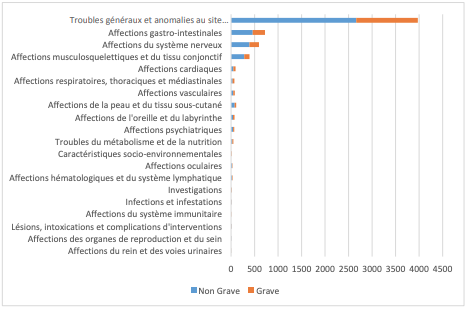
Sur la dernière période analysée (26 février au 4 mars), 1 020 cas attribuables à la vaccination ont été retenus, survenus dans 2/3 des cas chez des femmes. Un peu plus d'un quart (27,8 %) de ces effets indésirables sont considérés graves (1 décès chez une personne cumulant plusieurs comorbidités, 12 hospitalisations). La majorité des cas (62,5 %) se rapporte à des troubles généraux et anomalies au site d'injection (cf. Tableau II).
Le décès rapporté en France en semaine 4 est survenu après injection d'une dose du lot ABV5045.
Tableau II - Répartition des 6362 effets indésirables par System Organ Class (SOC)
Ne pas négliger la gravité potentielle des effets pseudo-grippaux
Les syndromes pseudo-grippaux peuvent entraîner des complications sévères (désaturation, méningisme, fièvre à 41°C, convulsion, perte de connaissance avec chutes traumatiques, délire/hallucinations, cyanose des extrémités, hypothermies, etc.), en particulier dans certaines populations.
Dans ce quatrième rapport, les auteurs proposent d'accroître la vigilance dans les populations susceptibles de voir leurs comorbidités décompenser :
- exacerbations de dyspnées et d'asthmes,
- troubles du rythme,
- poussées hypertensives hors syndrome grippal,
- réactions anaphylactiques/urticaires,
- hypotensions,
- hypothermies,
- lymphopénies,
- déséquilibres diabétiques,
- myo-péricardites/péricardites.
Vaccins à ARNm : pas de signal de sécurité
L'ANSM a également publié les rapports hebdomadaires relatifs à la surveillance des vaccins à ARNm :
Vaccin COMIRNATY : un signal potentiel relatif à la récidive de thrombopénie suite à la seconde dose
Depuis le début de la vaccination, 8 487 cas d'effets indésirables associés au vaccin COMIRNATY ont été analysés en France, dont 1 528 nouveaux cas signalés entre le 26 février et le 4 mars 2021. Au cours de la semaine 9, la proportion de cas graves reste stable par rapport aux analyses précédentes (24 %). La majorité des cas (graves et non graves) correspondent à des troubles généraux et anomalies au site d'injection.
Vaccin Moderna : la surveillance de certains événements indésirables se poursuit
Largement moins utilisé en France, le vaccin Moderna a été administré à 242 797 français (données au 4 mars), dont 50 544 au cours de la semaine du 26 février au 4 mars 2021 (1re ou 2e dose).
Cette cinquième période de surveillance de la sécurité du vaccin MODERNA en France ne montre aucun signal particulier.
Depuis le début de la vaccination avec ce vaccin, 302 cas d'effets indésirables ont été analysés, dont 82 en semaine 9 (18 cas correspondent à des effets inattendus).
La majorité des cas correspond à des réactions retardées locales non graves (plus de 80 %).
La surveillance attentive des cas d'hypertension artérielle, d'arythmie et de zona se poursuit.
Pour aller plus loin
Point de situation sur la surveillance des vaccins contre la COVID-19 (ANSM, 12 mars 2021)
- VACCIN ASTRAZENECA - Rapport complet n° 4 (ANSM, 12 mars 2021)
- VACCIN COMIRNATY - Rapport complet n° 8 (ANSM, 12 mars 2021)
- VACCIN MODERNA - Rapport complet n° 5 (ANSM, 12 mars 2021)
SUSPENSION TEMPORAIRE DU VACCIN COVID-19 ASTRAZENECA (DGS-Urgent n° 2021-31, 15 mars 2021)
Suspension temporaire par mesure de précaution de l'utilisation du vaccin AstraZeneca en France dans l'attente d'un avis de l'agence européenne du médicament (EMA) (ANSM, 15 mars 2021)
COVID-19 Vaccine AstraZeneca : PRAC preliminary view suggests no specific issue with batch used in Austria (EMA, 10 mars 2021)
COVID-19 Vaccine AstraZeneca: PRAC investigating cases of thromboembolic events - vaccine's benefits currently still outweigh risks - Update (EMA, 11 mars 2021)
EMA's safety committee continues investigation of COVID-19 Vaccine AstraZeneca and thromboembolic events – further update (EMA, 15 mars 2021)
Point de situation sur le lot ABV5300 du vaccin AstraZeneca contre la COVID-19 (ANSM, 13 mars 2021)
Pour aller plus loin
Consultez les monographies VIDAL
Consultez les VIDAL Recos
Pour recevoir gratuitement toute l’actualité par mail Je m'abonne !

 7 minutes
7 minutes Ajouter un commentaire
Ajouter un commentaire





Commentaires
Cliquez ici pour revenir à l'accueil.