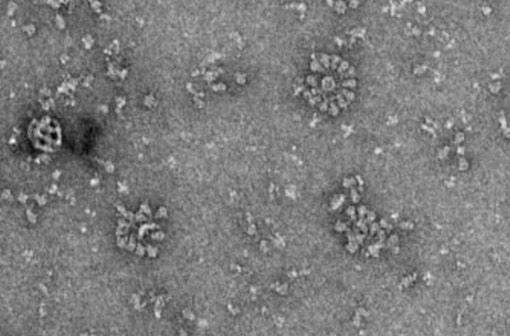
Le vaccin NVX-CoV2373 du laboratoire Novavax se compose de rosettes de protéines S plantées dans des nanoparticules (photo Novavax).
Le 2 février 2021, le laboratoire Novavax a publié les résultats de l'analyse intermédiaire de 2 essais cliniques (phase 2 et 3) menés sur son vaccin NVX-CoV2373. Depuis quelques mois, ce vaccin, d'un type différent des autres vaccins en développement avancé, est suivi de près par la communauté scientifique, intriguée par les très bons résultats obtenus chez les macaques et par l'influence de son adjuvant particulier, la Matrix-M, sur l'immunité obtenue après vaccination.
De quoi se compose le vaccin NVX-CoV2373 ?
Le vaccin NVX-CoV2373 se compose de protéines Spike (S) de SARS-CoV-2, dans leur intégralité, zone transmembranaire incluse. Produites dans des cellules d'insecte (issues de larves de la noctuelle américaine du maïs, Spodoptera frugiperda) infectées par un baculovirus recombinant, ces protéines sont légèrement modifiées pour que le site de clivage polybasique (la « charnière » entre les deux sous-unités de S) soit stable, la protéine S étant alors immobilisée dans sa configuration de « préfusion » avec la cellule cible.
La partie transmembranaire de ces protéines est insérée dans des nanoparticules lipidiques. On obtient ainsi des « rosettes » portant chacune quelques copies de S, présentées aux cellules immunitaires comme c'est le cas avec une particule de SARS-CoV-2.
À cette construction est ajouté un adjuvant original, développé par Novavax, la Matrix-M, un dérivé de saponines extraites du bois de Panama (Quillaja saponaria molina). Cet adjuvant a été testé dans d'autres projets de vaccins Novavax, chez plus de 4 300 personnes âgées de 5 mois à 85 ans, y compris chez des femmes enceintes.
Ce vaccin, présenté sous forme liquide, peut être conservé à une température comprise entre 2 et 8°C.
L'intérêt de l'adjuvant Matrix-M
Dans le contexte d'un projet de vaccin Novavax contre la grippe, l'ajout de Matrix-M a élargi le répertoire d'épitopes (les parties de la protéine contre lesquelles se créent des anticorps) neutralisés par les anticorps induits par le vaccin. De plus, il a entraîné une réponse immunitaire significative vis-à-vis de souches de virus influenza autres que celle utilisée pour créer ce vaccin (H3N2).
Dans l'essai de phase 1 sur le vaccin NVX-CoV2373 (131 patients en Australie, âge moyen 31 ans), la présence de l'adjuvant Matrix-M a permis d'utiliser de petites doses de vaccin (5 µg) et d'obtenir néanmoins des taux d'anticorps neutralisants en moyenne 6 fois supérieurs à ceux observés chez des patients ayant eu une forme asymptomatique de COVID-19 (et égaux aux taux des patients convalescents après une hospitalisation pour COVID-19). De plus, l'ajout de Matrix-M s'est ensuivi d'une réponse cellulaire robuste.
Ces résultats de bonne immunogénicité ont été mis en évidence 35 jours après 2 injections de vaccin à 3 semaines d'intervalle (5 µg de vaccin + 50 µg de Matrix-M). Des taux significatifs d'anticorps neutralisants étaient toujours mesurables 6 mois après les injections.
Les effets indésirables ont essentiellement été des réactions post-injection : maux de tête, courbatures, fatigue, réaction locale au point d'injection.
Le seul vaccin à provoquer une immunité stérilisante chez les macaques
Les résultats obtenus en vaccinant des macaques sont à l'origine de l'intérêt précoce de la communauté scientifique pour le vaccin NVX-CoV2373. En effet, lorsque des macaques vaccinés ont été infectés par le SARS-CoV-2 (voies intranasale et intratrachéale), ils ont, non seulement développé une inflammation significativement réduite des poumons (l'unique signe de COVID-19 dans cette espèce), mais également une absence de traces d'ARN viral dans le nez et le liquide de lavage broncho-alvéolaire.
Chez le macaque, de tous les vaccins testés contre la COVID-19, seul NVX-CoV2373 a montré cette immunité dite « stérilisante », c'est-à-dire capable d'empêcher la réplication de SARS-CoV-2 dans les voies respiratoires. Cette observation rend plus probable le fait que ce vaccin puisse empêcher la transmission de ce coronavirus par les personnes vaccinées.
Une étude de phase 2a menée aux États-Unis et en Australie
La première étude de phase 2 a été menée sur 1 288 personnes dont 50 % étaient âgées de plus de 60 ans (jusqu'à 84 ans). Elle a comparé cinq protocoles : 5 ou 25 µg de vaccin + 50 µg de Matrix-M, à raison de 2 injections à 3 semaines d'intervalle ; 1 injection du vaccin (5 ou 25 µg) suivie d'un placebo ; 2 injections de placebo).
Cet essai a ainsi pu montrer que le dosage de 25 µg n'apporte pas d'avantages immunitaires comparé à celui de 5 µg et que 2 injections sont nécessaires pour obtenir une réaction immunogène optimale.
Les effets indésirables survenus après l'injection étaient moins intenses chez les personnes de plus de 60 ans et plus fréquemment observés après la 2e injection (fatigue, maux de tête, courbatures ; durée moyenne de 2 jours).
Les résultats de l'étude de phase 3 en cours au Royaume-Uni
Le 2 février 2021, Novavax a présenté les résultats de deux essais cliniques, un de phase 2b en Afrique du Sud, un de phase 3 au Royaume-Uni.
Cette dernière étude, randomisée, en double aveugle contre placebo, a porté sur 15 000 personnes, âgées de 18 à 84 ans (27 % avaient plus de 65 ans). Le critère principal d'efficacité était le nombre d'épisodes symptomatiques de COVID-19 confirmés par PCR, mesurés à partir du 7e jour après la 2e injection.
L'analyse intermédiaire présentée révèle un taux de protection de 89,3 % (IC95 % : 75,2-95,4 ; 6 cas chez les patients vaccinés ; 56 cas, dont un sévère, chez les personnes ayant reçu le placebo). L'analyse finale aura lieu lorsque le nombre total de cas atteindra la centaine.
Dans cette étude clinique, parmi les 62 cas de COVID-19, 32 (52 %) étaient dus au variant B.1.1.7 (le « variant britannique », également appelé « 501Y.V1 »). Une analyse post hoc sur le taux de protection en fonction du variant a montré que :
Pour aller plus loin
L'étude de phase 1/2 menée avec diverses doses de NVX-CoV2373
Keech C, Albert G, Cho I et al. Phase 1ã2 Trial of a SARS-CoV-2 Recombinant Spike Protein Nanoparticle Vaccine. N Engl J Med 2020; 383:2320-2332.
L'étude montrant une immunité stérilisante chez les macaques
Guebre-Xabier M, Patel N, Tian JH et al. NVX-CoV2373 vaccine protects cynomolgus macaque upper and lower airways against SARS-CoV-2 challenge. Vaccine. 2020 Nov 25; 38(50): 7892ã7896.
Le communiqué de presse de Novavax relatif aux essais au Royaume-Uni et en Afrique du Sud
Novavax COVID-19 Vaccine Demonstrates 89.3% Efficacy in UK Phase 3 Trial. Novavax, 28 janvier 2021
La présentation de Novavax sur le développement de NVX-CoV2373 et les essais britannique et sud-africain
Efficacy Data Updates from Novavax'Protein-based Vaccine Candidate, 2 février 2021
Le protocole de l'étude de phase 3 menée au Royaume-Uni (NCT04583995)
Le protocole de l'étude de phase 2b menée en Afrique du Sud (NCT04533399)
Le protocole de l'étude de phase 3 menée aux États-Unis et au Mexique (PREVENT-19, NCT04611802)
L'annonce des résultats de l'essai de phase 3 (ENSEMBLE) du vaccin Johnson & Johnson
Johnson & Johnson Announces Single-Shot Janssen COVID-19 Vaccine Candidate Met Primary Endpoints in Interim Analysis of its Phase 3 ENSEMBLE Trial, 29 janvier 2021
De quoi se compose le vaccin NVX-CoV2373 ?
Le vaccin NVX-CoV2373 se compose de protéines Spike (S) de SARS-CoV-2, dans leur intégralité, zone transmembranaire incluse. Produites dans des cellules d'insecte (issues de larves de la noctuelle américaine du maïs, Spodoptera frugiperda) infectées par un baculovirus recombinant, ces protéines sont légèrement modifiées pour que le site de clivage polybasique (la « charnière » entre les deux sous-unités de S) soit stable, la protéine S étant alors immobilisée dans sa configuration de « préfusion » avec la cellule cible.
La partie transmembranaire de ces protéines est insérée dans des nanoparticules lipidiques. On obtient ainsi des « rosettes » portant chacune quelques copies de S, présentées aux cellules immunitaires comme c'est le cas avec une particule de SARS-CoV-2.
À cette construction est ajouté un adjuvant original, développé par Novavax, la Matrix-M, un dérivé de saponines extraites du bois de Panama (Quillaja saponaria molina). Cet adjuvant a été testé dans d'autres projets de vaccins Novavax, chez plus de 4 300 personnes âgées de 5 mois à 85 ans, y compris chez des femmes enceintes.
Ce vaccin, présenté sous forme liquide, peut être conservé à une température comprise entre 2 et 8°C.
L'intérêt de l'adjuvant Matrix-M
Dans le contexte d'un projet de vaccin Novavax contre la grippe, l'ajout de Matrix-M a élargi le répertoire d'épitopes (les parties de la protéine contre lesquelles se créent des anticorps) neutralisés par les anticorps induits par le vaccin. De plus, il a entraîné une réponse immunitaire significative vis-à-vis de souches de virus influenza autres que celle utilisée pour créer ce vaccin (H3N2).
Dans l'essai de phase 1 sur le vaccin NVX-CoV2373 (131 patients en Australie, âge moyen 31 ans), la présence de l'adjuvant Matrix-M a permis d'utiliser de petites doses de vaccin (5 µg) et d'obtenir néanmoins des taux d'anticorps neutralisants en moyenne 6 fois supérieurs à ceux observés chez des patients ayant eu une forme asymptomatique de COVID-19 (et égaux aux taux des patients convalescents après une hospitalisation pour COVID-19). De plus, l'ajout de Matrix-M s'est ensuivi d'une réponse cellulaire robuste.
Ces résultats de bonne immunogénicité ont été mis en évidence 35 jours après 2 injections de vaccin à 3 semaines d'intervalle (5 µg de vaccin + 50 µg de Matrix-M). Des taux significatifs d'anticorps neutralisants étaient toujours mesurables 6 mois après les injections.
Les effets indésirables ont essentiellement été des réactions post-injection : maux de tête, courbatures, fatigue, réaction locale au point d'injection.
Le seul vaccin à provoquer une immunité stérilisante chez les macaques
Les résultats obtenus en vaccinant des macaques sont à l'origine de l'intérêt précoce de la communauté scientifique pour le vaccin NVX-CoV2373. En effet, lorsque des macaques vaccinés ont été infectés par le SARS-CoV-2 (voies intranasale et intratrachéale), ils ont, non seulement développé une inflammation significativement réduite des poumons (l'unique signe de COVID-19 dans cette espèce), mais également une absence de traces d'ARN viral dans le nez et le liquide de lavage broncho-alvéolaire.
Chez le macaque, de tous les vaccins testés contre la COVID-19, seul NVX-CoV2373 a montré cette immunité dite « stérilisante », c'est-à-dire capable d'empêcher la réplication de SARS-CoV-2 dans les voies respiratoires. Cette observation rend plus probable le fait que ce vaccin puisse empêcher la transmission de ce coronavirus par les personnes vaccinées.
Une étude de phase 2a menée aux États-Unis et en Australie
La première étude de phase 2 a été menée sur 1 288 personnes dont 50 % étaient âgées de plus de 60 ans (jusqu'à 84 ans). Elle a comparé cinq protocoles : 5 ou 25 µg de vaccin + 50 µg de Matrix-M, à raison de 2 injections à 3 semaines d'intervalle ; 1 injection du vaccin (5 ou 25 µg) suivie d'un placebo ; 2 injections de placebo).
Cet essai a ainsi pu montrer que le dosage de 25 µg n'apporte pas d'avantages immunitaires comparé à celui de 5 µg et que 2 injections sont nécessaires pour obtenir une réaction immunogène optimale.
Les effets indésirables survenus après l'injection étaient moins intenses chez les personnes de plus de 60 ans et plus fréquemment observés après la 2e injection (fatigue, maux de tête, courbatures ; durée moyenne de 2 jours).
Les résultats de l'étude de phase 3 en cours au Royaume-Uni
Le 2 février 2021, Novavax a présenté les résultats de deux essais cliniques, un de phase 2b en Afrique du Sud, un de phase 3 au Royaume-Uni.
Cette dernière étude, randomisée, en double aveugle contre placebo, a porté sur 15 000 personnes, âgées de 18 à 84 ans (27 % avaient plus de 65 ans). Le critère principal d'efficacité était le nombre d'épisodes symptomatiques de COVID-19 confirmés par PCR, mesurés à partir du 7e jour après la 2e injection.
L'analyse intermédiaire présentée révèle un taux de protection de 89,3 % (IC95 % : 75,2-95,4 ; 6 cas chez les patients vaccinés ; 56 cas, dont un sévère, chez les personnes ayant reçu le placebo). L'analyse finale aura lieu lorsque le nombre total de cas atteindra la centaine.
Dans cette étude clinique, parmi les 62 cas de COVID-19, 32 (52 %) étaient dus au variant B.1.1.7 (le « variant britannique », également appelé « 501Y.V1 »). Une analyse post hoc sur le taux de protection en fonction du variant a montré que :
- pour le variant « historique », le taux de protection était de 95,6 % (IC95 % non communiqué) ;
- pour le variant « britannique », le taux de protection était de 85,6 % (IC95 % non communiqué).
Sur le versant de la sécurité, les effets indésirables ont été en ligne avec ceux de l'essai de phase 2a, équilibrés entre les deux groupes. Des effets graves ont été rapportés chez 1,1 % des personnes vaccinées et 0,7 % des non vaccinées.
À la suite de l'analyse intermédiaire de cette étude de phase 3, Novavax a annoncé avoir débuté une révision en continu (« rolling review ») de ses données avec le MHRA (l'agence britannique du médicament) mi-janvier et avec l'EMA (Agence européenne du médicament) le 3 février 2021, en vue de l'attribution d'une AMM.
Les résultats de l'étude de phase 2b en cours en Afrique du Sud
Le 2 février 2021, Novavax a également présenté l'analyse intermédiaire d'un essai clinique de phase 2b mené en Afrique du Sud. Ce dernier a dévoilé des informations intéressantes même si certaines sont sujettes à réserves du fait des petits effectifs.
Cette étude randomisée en double aveugle contre placebo a porté sur 4 406 personnes assez jeunes (âge moyen : 28 ans), dont 245 étaient séropositives pour le VIH/sida (« VIH+ ») afin de refléter partiellement la réalité sanitaire dans ce pays (19 % de personnes VIH+ chez les adultes).
Lorsque tous les patients ont été pris en compte, le taux de protection était de 49,4 % (IC95 % : 6,1-72,8 ; 15 cas chez les personnes vaccinées contre 29 cas dans le groupe contrôle, dont un sévère), soit nettement inférieur à celui obtenu au Royaume-Uni.
Lorsque seules les personnes séronégatives pour le VIH/sida ont été prises en compte, le taux de protection était de 60,1 % (IC95 % : 19,9-80,1 ; 11 cas contre 27). L'effectif du groupe VIH+ et le nombre de cas de COVID-19 sont, à ce stade, trop faibles pour déterminer le taux de protection dans cette population.
L'hypothèse, selon laquelle ce plus faible taux de protection (49,4 % versus 89,3 % au Royaume-Uni) serait dû à la prédominance, en Afrique du Sud, du variant B.1.351 (variant « sud-africain » ou « 501Y.V2 »), se trouve confortée par le séquençage des virus responsables des cas de COVID-19 rapportés dans cette étude : sur 27 résultats de séquençage disponibles, 25 ont révélé un variant B.1.351 (92,6 %).
Ainsi, malgré les effectifs relativement réduits de cette étude, le vaccin NVX-CoV2373 semble offrir une protection moins élevée contre les infections par le variant « sud-africain » que contre le variant « historique » ou le variant « britannique », mais néanmoins supérieure au seuil minimal de protection retenu par les agences de régulation (50 %).
Ces résultats évoquent ceux communiqués le 29 janvier 2021 par Johnson & Johnson (Janssen) à propos de l'étude de phase 3 ENSEMBLE de son vaccin Ad.26.COV2.S (ou JNJ-78436725) : dans l'analyse intermédiaire, le taux de protection contre les formes « modérées à sévères » (28 jours après l'injection de ce vaccin à dose unique) était de 72 % aux États-Unis, mais de 57 % en Afrique du Sud (chez des patients séronégatifs pour le VIH/sida). À noter que ce taux était de 85 % quel que soit le pays contre les formes « sévères à critiques » (IC95 % non communiqué).
Des cas de réinfection signalés parmi les participants de l'étude sud-africaine
L'étude sud-africaine révèle une autre information, relative aux réinfections. En effet, lors de la phase de sélection, il est apparu qu'environ un tiers des participants avaient une sérologie positive pour SARS-CoV-2 (29,6 % dans le groupe vaccin et 30,8 % dans le groupe témoin), probablement due au variant « historique ». Ces personnes ont été incluses dans l'étude et suivies, mais n'ont pas été intégrées dans l'analyse d'efficacité présentée ci-dessus (ce qui, en réduisant l'effectif, réduit la significativité des taux de protection présentés par Novavax).
Dans le groupe placebo, le pourcentage de personnes ayant eu un épisode de COVID-19 symptomatique, confirmée par PCR, était le même chez celles qui avaient déjà été infectées par SARS-CoV-2 que chez les autres (3,9 % dans les deux groupes, dont un peu plus de 2 % de formes modérées à sévères, les (ré)infections s'étant plutôt déclarées entre les 2 injections de vaccin).
Ainsi, avoir été infecté par le variant « historique » ne semble pas protéger contre le variant B.1.351. De plus, les concentrations sanguines des personnes qui avaient des anticorps contre SARS-CoV-2 à l'inclusion, n'étaient pas corrélées au risque d'être réinfecté pendant l'étude.
Une autre étude de phase 3 est en cours aux États-Unis et au Mexique
Dans sa présentation du 2 février 2021, Novavax a également donné des nouvelles de son autre essai clinique de phase 3, PREVENT-19, qui portera sur 30 000 personnes aux États-Unis et au Mexique (NCT04611802). Cette étude a déjà enrôlé 20 000 personnes dont 16 % de plus de 65 ans et des pourcentages significatifs de personnes représentatives des minorités raciales de ces deux pays.
Pour enrôler les sujets le plus vite possible, avant que la pandémie ne diminue et pour éviter la concurrence des campagnes de vaccination débutantes, Novavax a eu recours à des mesures innovantes pour augmenter l'attractivité de son étude.
Tout d'abord, la randomisation a lieu dans un rapport 2:1 (deux fois plus de chances d'être dans le groupe vacciné). De plus, pour s'assurer que les participants ne sortent pas de l'essai pour se faire vacciner dans le circuit général, Novavax a obtenu des agences de régulation le droit de pratiquer un cross-over : en double aveugle, les patients vaccinés recevront, après leurs 2 injections de vaccin, 2 injections de placebo, tandis que les patients ayant reçu le placebo recevront ensuite 2 injections de vaccin (avec un intervalle suffisant entre les deux protocoles pour obtenir des résultats comparatifs d'efficacité). Ainsi, en quelques mois, tous les participants de l'étude auront été vaccinés.
D'après Novavax, l'inclusion sera terminée à la mi-février et une analyse intermédiaire sera publiée lorsque 72 cas de COVID-19 auront été enregistrés (l'analyse finale aura lieu après 144 cas).
Novavax envisage déjà d'adapter son vaccin aux nouveaux variants
Novavax a en outre annoncé se lancer dans la préparation d'un vaccin contenant des protéines S issues des différents variants, vaccin qui pourrait être utilisé comme 3e injection (rappel) après NVX-CoV2373 ou un autre vaccin, pour étendre le répertoire d'anticorps neutralisants. Un essai dans ce sens devrait commencer au printemps.
En conclusion, le vaccin NVX-CoV2373 semble tenir les promesses suggérées par ses essais de phase 1 et 2. En attendant des données d'efficacité et de sécurité plus détaillées et plus complètes que cette première communication du laboratoire Novavax, cette analyse intermédiaire révèle de nouveaux enjeux :
À la suite de l'analyse intermédiaire de cette étude de phase 3, Novavax a annoncé avoir débuté une révision en continu (« rolling review ») de ses données avec le MHRA (l'agence britannique du médicament) mi-janvier et avec l'EMA (Agence européenne du médicament) le 3 février 2021, en vue de l'attribution d'une AMM.
Les résultats de l'étude de phase 2b en cours en Afrique du Sud
Le 2 février 2021, Novavax a également présenté l'analyse intermédiaire d'un essai clinique de phase 2b mené en Afrique du Sud. Ce dernier a dévoilé des informations intéressantes même si certaines sont sujettes à réserves du fait des petits effectifs.
Cette étude randomisée en double aveugle contre placebo a porté sur 4 406 personnes assez jeunes (âge moyen : 28 ans), dont 245 étaient séropositives pour le VIH/sida (« VIH+ ») afin de refléter partiellement la réalité sanitaire dans ce pays (19 % de personnes VIH+ chez les adultes).
Lorsque tous les patients ont été pris en compte, le taux de protection était de 49,4 % (IC95 % : 6,1-72,8 ; 15 cas chez les personnes vaccinées contre 29 cas dans le groupe contrôle, dont un sévère), soit nettement inférieur à celui obtenu au Royaume-Uni.
Lorsque seules les personnes séronégatives pour le VIH/sida ont été prises en compte, le taux de protection était de 60,1 % (IC95 % : 19,9-80,1 ; 11 cas contre 27). L'effectif du groupe VIH+ et le nombre de cas de COVID-19 sont, à ce stade, trop faibles pour déterminer le taux de protection dans cette population.
L'hypothèse, selon laquelle ce plus faible taux de protection (49,4 % versus 89,3 % au Royaume-Uni) serait dû à la prédominance, en Afrique du Sud, du variant B.1.351 (variant « sud-africain » ou « 501Y.V2 »), se trouve confortée par le séquençage des virus responsables des cas de COVID-19 rapportés dans cette étude : sur 27 résultats de séquençage disponibles, 25 ont révélé un variant B.1.351 (92,6 %).
Ainsi, malgré les effectifs relativement réduits de cette étude, le vaccin NVX-CoV2373 semble offrir une protection moins élevée contre les infections par le variant « sud-africain » que contre le variant « historique » ou le variant « britannique », mais néanmoins supérieure au seuil minimal de protection retenu par les agences de régulation (50 %).
Ces résultats évoquent ceux communiqués le 29 janvier 2021 par Johnson & Johnson (Janssen) à propos de l'étude de phase 3 ENSEMBLE de son vaccin Ad.26.COV2.S (ou JNJ-78436725) : dans l'analyse intermédiaire, le taux de protection contre les formes « modérées à sévères » (28 jours après l'injection de ce vaccin à dose unique) était de 72 % aux États-Unis, mais de 57 % en Afrique du Sud (chez des patients séronégatifs pour le VIH/sida). À noter que ce taux était de 85 % quel que soit le pays contre les formes « sévères à critiques » (IC95 % non communiqué).
Des cas de réinfection signalés parmi les participants de l'étude sud-africaine
L'étude sud-africaine révèle une autre information, relative aux réinfections. En effet, lors de la phase de sélection, il est apparu qu'environ un tiers des participants avaient une sérologie positive pour SARS-CoV-2 (29,6 % dans le groupe vaccin et 30,8 % dans le groupe témoin), probablement due au variant « historique ». Ces personnes ont été incluses dans l'étude et suivies, mais n'ont pas été intégrées dans l'analyse d'efficacité présentée ci-dessus (ce qui, en réduisant l'effectif, réduit la significativité des taux de protection présentés par Novavax).
Dans le groupe placebo, le pourcentage de personnes ayant eu un épisode de COVID-19 symptomatique, confirmée par PCR, était le même chez celles qui avaient déjà été infectées par SARS-CoV-2 que chez les autres (3,9 % dans les deux groupes, dont un peu plus de 2 % de formes modérées à sévères, les (ré)infections s'étant plutôt déclarées entre les 2 injections de vaccin).
Ainsi, avoir été infecté par le variant « historique » ne semble pas protéger contre le variant B.1.351. De plus, les concentrations sanguines des personnes qui avaient des anticorps contre SARS-CoV-2 à l'inclusion, n'étaient pas corrélées au risque d'être réinfecté pendant l'étude.
Une autre étude de phase 3 est en cours aux États-Unis et au Mexique
Dans sa présentation du 2 février 2021, Novavax a également donné des nouvelles de son autre essai clinique de phase 3, PREVENT-19, qui portera sur 30 000 personnes aux États-Unis et au Mexique (NCT04611802). Cette étude a déjà enrôlé 20 000 personnes dont 16 % de plus de 65 ans et des pourcentages significatifs de personnes représentatives des minorités raciales de ces deux pays.
Pour enrôler les sujets le plus vite possible, avant que la pandémie ne diminue et pour éviter la concurrence des campagnes de vaccination débutantes, Novavax a eu recours à des mesures innovantes pour augmenter l'attractivité de son étude.
Tout d'abord, la randomisation a lieu dans un rapport 2:1 (deux fois plus de chances d'être dans le groupe vacciné). De plus, pour s'assurer que les participants ne sortent pas de l'essai pour se faire vacciner dans le circuit général, Novavax a obtenu des agences de régulation le droit de pratiquer un cross-over : en double aveugle, les patients vaccinés recevront, après leurs 2 injections de vaccin, 2 injections de placebo, tandis que les patients ayant reçu le placebo recevront ensuite 2 injections de vaccin (avec un intervalle suffisant entre les deux protocoles pour obtenir des résultats comparatifs d'efficacité). Ainsi, en quelques mois, tous les participants de l'étude auront été vaccinés.
D'après Novavax, l'inclusion sera terminée à la mi-février et une analyse intermédiaire sera publiée lorsque 72 cas de COVID-19 auront été enregistrés (l'analyse finale aura lieu après 144 cas).
Novavax envisage déjà d'adapter son vaccin aux nouveaux variants
Novavax a en outre annoncé se lancer dans la préparation d'un vaccin contenant des protéines S issues des différents variants, vaccin qui pourrait être utilisé comme 3e injection (rappel) après NVX-CoV2373 ou un autre vaccin, pour étendre le répertoire d'anticorps neutralisants. Un essai dans ce sens devrait commencer au printemps.
En conclusion, le vaccin NVX-CoV2373 semble tenir les promesses suggérées par ses essais de phase 1 et 2. En attendant des données d'efficacité et de sécurité plus détaillées et plus complètes que cette première communication du laboratoire Novavax, cette analyse intermédiaire révèle de nouveaux enjeux :
- la nécessité d'intégrer, dès que possible, les protéines S des variants (en particulier le variant B.1.351 « sud-africain » et le variant P.1 « brésilien ») dans les vaccins ;
- la nécessité de mener des études sur l'efficacité des vaccins contre la COVID-19 chez les personnes VIH+ (et les personnes immunodéprimées en général).
De plus, ces résultats renforcent les arguments des professionnels de santé et des épidémiologistes, qui insistent sur l'importance de tout mettre en éuvre rapidement, pour éviter que les variants B.1.351 et P.1 ne deviennent prévalents en Europe : mesures barrières renforcées, réduction des contacts, séquençage plus systématique des virus circulants, isolement strict des personnes infectées par ces variants, vaccination au plus vite des personnes vulnérables, strict respect des calendriers de vaccination, etc.
L'apparition récente, dans des variants « britanniques », de la mutation E484K (présente sur le RBD ã Receptor Binding Domain - des variants « sud-africain » et « brésilien » et suspectée d'être au céur de leur résistance aux anticorps vaccinaux) plaide également pour l'application rapide de telles mesures.
©vidal.fr
L'apparition récente, dans des variants « britanniques », de la mutation E484K (présente sur le RBD ã Receptor Binding Domain - des variants « sud-africain » et « brésilien » et suspectée d'être au céur de leur résistance aux anticorps vaccinaux) plaide également pour l'application rapide de telles mesures.
©vidal.fr
Pour aller plus loin
L'étude de phase 1/2 menée avec diverses doses de NVX-CoV2373
Keech C, Albert G, Cho I et al. Phase 1ã2 Trial of a SARS-CoV-2 Recombinant Spike Protein Nanoparticle Vaccine. N Engl J Med 2020; 383:2320-2332.
L'étude montrant une immunité stérilisante chez les macaques
Guebre-Xabier M, Patel N, Tian JH et al. NVX-CoV2373 vaccine protects cynomolgus macaque upper and lower airways against SARS-CoV-2 challenge. Vaccine. 2020 Nov 25; 38(50): 7892ã7896.
Le communiqué de presse de Novavax relatif aux essais au Royaume-Uni et en Afrique du Sud
Novavax COVID-19 Vaccine Demonstrates 89.3% Efficacy in UK Phase 3 Trial. Novavax, 28 janvier 2021
La présentation de Novavax sur le développement de NVX-CoV2373 et les essais britannique et sud-africain
Efficacy Data Updates from Novavax'Protein-based Vaccine Candidate, 2 février 2021
Le protocole de l'étude de phase 3 menée au Royaume-Uni (NCT04583995)
Le protocole de l'étude de phase 2b menée en Afrique du Sud (NCT04533399)
Le protocole de l'étude de phase 3 menée aux États-Unis et au Mexique (PREVENT-19, NCT04611802)
L'annonce des résultats de l'essai de phase 3 (ENSEMBLE) du vaccin Johnson & Johnson
Johnson & Johnson Announces Single-Shot Janssen COVID-19 Vaccine Candidate Met Primary Endpoints in Interim Analysis of its Phase 3 ENSEMBLE Trial, 29 janvier 2021
Sources
Pour recevoir gratuitement toute lãactualitûˋ par mail Je m'abonne !

 11 minutes
11 minutes Ajouter un commentaire
Ajouter un commentaire






Commentaires
Cliquez ici pour revenir à l'accueil.