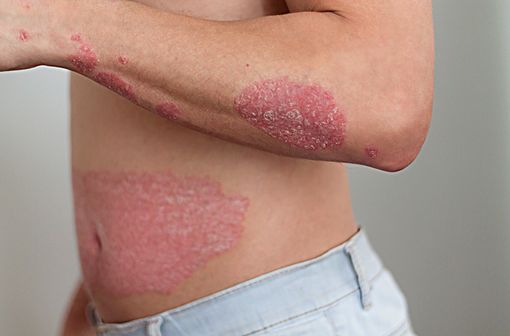
Le psoriasis en plaques se traduit par l’apparition de plaques rouges souvent irritantes et d’une accumulation de squames qui peuvent se situer sur tout le corps (illustration).
L'arsenal thérapeutique du psoriasis en plaque s'enrichit d'une nouvelle spécialité immunosuppressive, ILUMETRI 100 mg/mL solution injectable SC en seringue préremplie.
ILUMETRI est formulé à partir de tildrakizumab, un nouvel anticorps monoclonal anti-interleukine 23 (anti-IL23), indiqué dans le traitement du psoriasis en plaques modéré à sévère chez l'adulte qui nécessite un traitement systémique (cf. VIDAL Reco "Psoriasis en plaques de l'adulte").
En tant que nouveau principe actif, ILUMETRI fait l'objet d'une surveillance supplémentaire qui permettra l'identification rapide de nouvelles informations relatives à la sécurité. Les professionnels de santé déclarent tout effet indésirable suspecté.
Évaluation du tildrakizumab versus placebo et versus étanercept
Dans son avis du 3 juin 2020, la Commission de la Transparence (CT) a évalué ILUMETRI (tildrakizumab) sur la base principalement de deux études cliniques de supériorité réalisées chez des adultes ayant un psoriasis modéré à sévère nécessitant un traitement systémique ou par photothérapie :
- étude ReSURFACE 1 (P010) : étude de phase III de supériorité, randomisée, en double aveugle, multicentrique, ayant comparé le tildrakizumab aux doses de 100 mg et 200 mg versus placebo (cf. Encadré 1),
- étude ReSURFACE 2 (P011) : étude de phase III de supériorité, randomisée, en double aveugle, multicentrique, ayant comparé le tildrakizumab aux doses de 100 mg et 200 mg versus placebo et versus étanercept 50 mg (cf. Encadré 2).
| Étude menée sur 772 patients. Critères de jugement principaux hiérarchisés :
|
| Étude menée sur 1 090 patients. Critères principaux hiérarchisés de la comparaison tildrakizumab (100 mg et 200 mg) versus placebo :
Après 12 semaines de traitement, le tildrakizumab 100 mg et 200 mg a montré sa supériorité par rapport au placebo sur les deux critères de jugement principaux :
|
*Le PASI (Psoriasis Area and Severity Index ) est un score qui permet d'évaluer l'aspect des plaques et leur localisation corporelle, allant de 0 (forme la moins sévère) à 72 (forme la plus sévère). La désignation PASI 75, correspond à une diminution d'au moins 75 % de la gravité du psoriasis sur l'échelle PASI par rapport à l'inclusion.
**PGA (Physician's Global Assessment ) est un autre score reposant sur la description de l'aspect des plaques de psoriasis sur une échelle allant de 0 (blanchi) à 5 (très sévère).
En termes de tolérance, le profil du tildrakizumab a été comparable aux autres anti-interleukines, avec principalement des infections des voies respiratoires supérieures et des réactions au site d'injection.
SMR important dans un périmètre restreint, comme pour les autres anti-IL23 déjà disponibles
Au terme de son évaluation, la Commission de la Transparence a attribué à ILUMETRI un SMR (service médical rendu) important, sans amélioration du SMR (ASMR V), uniquement dans le traitement du psoriasis en plaques chronique sévère de l'adulte défini par :
- un échec (réponse insuffisante, contre-indication ou intolérance) à au moins deux traitements parmi les traitements systémiques non biologiques et la photothérapie,
- et une forme étendue et/ou un retentissement psychosocial important.
ILUMETRI en pratique
ILUMETRI est destiné à être utilisé sous la conduite et la surveillance d'un médecin expérimenté dans le diagnostic et le traitement du psoriasis en plaques.
- Schéma posologique progressif
- 100 mg aux semaines 0 et 4,
- puis 100 mg toutes les 12 semaines.
Une dose plus élevée, de 200 mg, peut être envisagée chez des patients présentant certaines caractéristiques (par exemple une charge de morbidité élevée, un poids corporel > ou = à 90 kg), pour apporter une plus grande efficacité.
Avant l'instauration d'un traitement par tildrakizumab, il est recommandé de s'assurer que les patients sont à jour de l'ensemble des vaccinations appropriées conformément aux recommandations vaccinales en vigueur.
- Durée du traitement : réévaluation à 7 mois
L'arrêt du traitement doit être envisagé chez les patients ne présentant pas de réponse après 28 semaines de traitement.
En cas de réponse partielle en début de traitement, une amélioration peut être obtenue en poursuivant le traitement au-delà de 28 semaines.
- Injection d'ILUMETRI : voie sous-cutanée
Elle doit être conservée au réfrigérateur, entre 2 et 8 °C.
| La seringue préremplie ILUMETRI est équipée d'une aiguille 29 G x 1/2, recouverte d'un protège-aiguille et d'une protection d'aiguille dans un dispositif de sécurité passive qui se déclenche après l'injection. Une fenêtre de visualisation de la dose est aménagée dans le corps de la seringue. 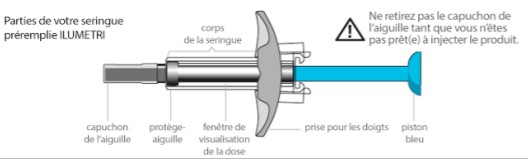 |
Avant l'injection, la seringue préremplie ne doit pas être agitée. Elle doit être sortie du réfrigérateur environ 30 minutes, pour permettre d'atteindre la température ambiante.
Une fois sortie du réfrigérateur, la seringue doit être utilisée dans les 30 jours (ou avant la date de péremption ; la date la plus courte étant retenue). Il est conseillé au patient de noter la date de sortie du réfrigérateur dans l'espace prévu sur l'emballage extérieur, ainsi que la date correspondant à la péremption après ouverture.
Les sites d'injection sont l'abdomen, la cuisse ou le haut du bras, à alterner.
Les zones suivantes doivent être évitées :
- zone où la peau est atteinte de psoriasis en plaques ou est sensible au toucher,
- zone présentant un hématome,
- peau rouge, indurée, épaissie ou squameuse.
L'auto-injection peut être envisagée sous condition :
- le patient doit recevoir une formation adaptée,
- le médecin valide cette option.
Compte tenu du risque de réactions d'hypersensibilité avec le tildrakizumab, la CT recommande que la 1re injection sous-cutanée soit réalisée dans une structure de soins adaptée.
Identité administrative
- Liste I
- Prescription initiale hospitalière annuelle
- Prescription initiale et renouvellement réservés aux spécialistes en dermatologie, en médecine interne
- Boîte de 1 seringue préremplie, CIP 3400930172056
- Remboursable à 65 % dans un périmètre défini (cf. Encadré 4), et selon la procédure des médicaments d'exception (Fiche d'information thérapeutique publiée au Journal officiel du 10 octobre 2020 - texte 20)
- Prix public TTC = 2 412,49 euros TTC
- Agrément aux collectivités dans un périmètre défini (Journal officiel du 10 octobre 2020 - texte 21)
- Laboratoire Almirall
Encadré 4 - Périmètre de prise en charge d'ILUMETRI
Traitement du psoriasis en plaques de l'adulte, chez les patients ayant un psoriasis en plaques chronique sévère, défini par :
|
Pour aller plus loin
Avis de la Commission de la Transparence - ILUMETRI (HAS, 3 juin 2020)

 6 minutes
6 minutes Ajouter un commentaire
Ajouter un commentaire





Commentaires
Cliquez ici pour revenir à l'accueil.