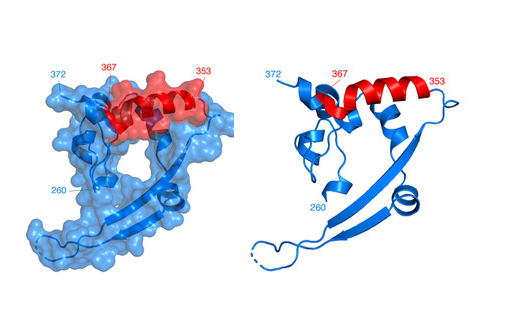
Structure tridimensionnelle du domaine C-terminal de la nucléoprotéine de MERS (Code PDB: 6G13). Les résidus sont annotés par leur position dans la séquence. Le peptide N353-367 est figuré en rouge (illustration).
La vaccinologie contre les coronavirus, une science balbutiante
Aujourd'hui, sur le marché, il existe peu de vaccins contre les coronavirus (CoV), tous dans le domaine vétérinaire et, pour la vaste majorité d'entre eux, sous forme de vaccins vivants atténués : celui contre la péritonite infectieuse féline (PIF), ceux contre la bronchite infectieuse aviaire, celui contre la coronavirose entérale du chien et celui contre les diarrhées à coronavirus du veau, qui sert à vacciner la vache gestante pour obtenir des anticorps dans le colostrum.
Leur efficacité est relative. Par exemple, le vaccin contre la PIF n'est pas autorisé en France pour cette raison. Celui contre la bronchite infectieuse aviaire doit être administré toutes les 6 semaines pour obtenir une immunité protectrice.
Ainsi, la vaccinologie relative aux CoV est assez pauvre en applications pratiques. Néanmoins, sur le plan des connaissances de base, elle s'est récemment enrichie des travaux menés sur le SRAS et le MERS.
L'immunité cellulaire semble la seule indispensable à l'élimination du SARS-CoV-1 et du MERS-CoV
Lors de l'infection SRAS ou de MERS, les deux formes d'immunité sont mobilisées. Côté humoral, diverses études ont corrélé l'importance de la production d'anticorps neutralisants pendant la maladie à la résolution rapide des symptômes, mais pas à la disparition rapide de la charge virale. L'immunité cellulaire semble, elle, importante à la fois pendant la maladie, pour réduire la charge virale et stimuler l'immunité humorale, et après la guérison, dans la constitution de la mémoire immunitaire (voir ci-dessous). Elle est également essentielle à la constitution d'une immunité locale dans les muqueuses des voies aériennes, par le biais des IgA et des cellules dendritiques (qui présentent les antigènes aux lymphocytes T).
La surprise est venue lorsque des chercheurs ont inoculé des souris génétiquement modifiées pour n'avoir qu'une seule forme d'immunité. Pour le SARS-CoV-1, comme pour le MERS-CoV, les souris dépourvues d'immunité cellulaire ne parviennent pas à éliminer le virus et souffrent d'une forte mortalité malgré la production d'anticorps neutralisants. Mais celles dépourvues d'immunité humorale y parviennent aussi bien que des souris normales. L'immunité cellulaire est donc indispensable à l'élimination de ces CoV (ce qui, pour autant, ne rend pas inutile l'immunité humorale).
La mémoire immunitaire aux CoV : une affaire cellulaire
Plusieurs études se sont penchées sur la persistance de l'immunité spécifique après une infection par le SARS-CoV-1 ou le MERS-CoV. Concernant le SARS-CoV-1, 8 ans après l'infection, une étude portant sur une vingtaine de patients a montré une disparition complète des anticorps neutralisants spécifiques, mais aussi des lymphocytes B mémoire responsables de leur synthèse. Néanmoins, des lymphocytes T activement réactifs au SARS-CoV-1 ont été détectés jusqu'à 11 ans après la maladie, en particulier chez les personnes ayant souffert de formes sévères de l'infection.
Dans le cas du MERS-CoV, des anticorps neutralisants spécifiques ont été mesurés jusqu'à 34 mois après l'infection, mais on dispose de moins de recul qu'avec le SRAS. On ignore encore la durée de persistance de l'immunité cellulaire après un épisode de MERS. Ces résultats, pour préliminaires qu'ils soient, montre clairement l'importance de la mobilisation de l'immunité cellulaire dans une tentative de vaccination durable.
La sénescence de l'immunité cellulaire, un facteur de la vulnérabilité des personnes âgées ?
Une autre observation semble également pointer l'hypothèse d'un rôle central de l'immunité cellulaire dans l'élimination des CoV : la surmortalité observée chez les personnes (et les souris) âgées que ce soit pour le SRAS, le MERS ou la COVID-19. Certes, cette mortalité trouve également sa cause dans les pathologies intercurrentes plus fréquentes dans cette population. Mais les immunologistes font remarquer que l'âge exerce divers effets négatifs sur l'immunité : diminution du répertoire des cellules naïves B et T, moins bonne présentation des antigènes, récepteurs de type Toll moins fonctionnels (les TLR, chargés de reconnaître les motifs conservés entre différentes souches d'un même pathogène), baisse des capacités de migration des cellules dendritiques des voies respiratoires, etc.
De fait, l'administration de lymphocytes T issus de jeunes souris à des souris âgées infectées par le SARS-CoV-1 augmente significativement leur taux de survie, ce qui pourrait illustrer le rôle d'une baisse de l'immunité cellulaire dans la surmortalité des sujets âgés. Mais notons que l'administration d'anticorps neutralisants spécifiques peut également augmenter la survie de souris âgées infectées par SARS-CoV-1.
Des données récentes sur la réponse immunitaire pendant la COVID-19
Le 6 avril 2020, une étude a été mise en ligne (préprint, sans relecture par un comité) sur la réponse immunitaire humorale pendant la COVID-19, mesurée chez 175 patients (15-85 ans) atteints de formes légères de l'infection. Dix à 15 jours après le début des symptômes, la plupart des patients ont développé des anticorps neutralisants (dirigés contre les protéines S1, S2 et le RBD - receptor binding domain, la zone de la protéine S qui se fixe au récepteur cellulaire). Ces anticorps ne neutralisaient pas SARS-CoV-1. Environ 30 % des patients n'ont développé que des taux faibles d'anticorps neutralisants, et pour 10 patients, ce taux était en dessous du seuil de détectabilité.
Un point intéressant de cette étude est la différence de réponse immunitaire entre les 15-39 ans et les 40-59 ou les 60-85 ans. Ces deux derniers groupes avaient des taux sanguins d'anticorps neutralisants significativement plus élevés que les 15-39 ans, mais avaient des taux sanguins de lymphocytes significativement plus faibles. Ainsi, il se pourrait que la réponse humorale soit plus intense lorsque l'immunité cellulaire est moins performante (avec une possible corrélation avec la plus grande vulnérabilité des personnes âgées). À l'inverse, chez les patients les plus jeunes, la plus grande réactivité de l'immunité cellulaire rendrait moins essentielle la réponse humorale.
Stimuler l'immunité humorale : l'écueil des anticorps facilitants
Lorsque des immunologistes parlent de recherche vaccinale contre les CoV, le spectre des anticorps dits "facilitants" fait immédiatement naître un frisson d'anxiété. Ces anticorps (généralement des IgG, également appelés "non neutralisants") apparaissent après une première infection (ou une vaccination, par exemple dans le cas de la PIF ou de la dengue) et ont la fâcheuse particularité d'amener les virus qu'ils sont censés combattre directement au contact de cellules immunitaires… que ces mêmes virus s'empressent d'infecter, aggravant ainsi l'infection. Des anticorps facilitants ont été identifiés dans la dengue, la grippe, l'infection par le VIH/sida, Ebola et… le SRAS, entre autres. Dans le SRAS, ce n'est que 8 ans après l'épisode de 2003 que ces anticorps ont été mis en évidence.
Chez la souris, lors de tentatives de vaccination contre le SARS-CoV-1, le challenge post-vaccination fait apparaître des anticorps facilitants qui sont responsables d'hépatite, d'une augmentation de la morbidité et de l'intensification de la réaction inflammatoire. Ils pourraient également être impliqués dans l'apparition d'un choc cytokinique.
À ce jour, l'existence d'anticorps facilitants n'a pas été mise en évidence dans l'infection par le MERS-CoV, ni dans la réaction immunitaire à la suite d'un essai vaccinal contre ce CoV. Mais il est peut-être trop tôt pour éliminer définitivement cette possibilité.
Stimuler l'immunité humorale sans provoquer l'apparition d'anticorps facilitants
On sait désormais que, dans le cas de la vaccination contre le SRAS, l'apparition d'anticorps facilitants est plus fréquente lorsque l'antigène utilisé est la protéine S (spike protein, celle de la couronne du coronavirus) dans son intégralité. Pour prévenir cet effet indésirable, il existe deux stratégies :
Leur efficacité est relative. Par exemple, le vaccin contre la PIF n'est pas autorisé en France pour cette raison. Celui contre la bronchite infectieuse aviaire doit être administré toutes les 6 semaines pour obtenir une immunité protectrice.
Ainsi, la vaccinologie relative aux CoV est assez pauvre en applications pratiques. Néanmoins, sur le plan des connaissances de base, elle s'est récemment enrichie des travaux menés sur le SRAS et le MERS.
L'immunité cellulaire semble la seule indispensable à l'élimination du SARS-CoV-1 et du MERS-CoV
Lors de l'infection SRAS ou de MERS, les deux formes d'immunité sont mobilisées. Côté humoral, diverses études ont corrélé l'importance de la production d'anticorps neutralisants pendant la maladie à la résolution rapide des symptômes, mais pas à la disparition rapide de la charge virale. L'immunité cellulaire semble, elle, importante à la fois pendant la maladie, pour réduire la charge virale et stimuler l'immunité humorale, et après la guérison, dans la constitution de la mémoire immunitaire (voir ci-dessous). Elle est également essentielle à la constitution d'une immunité locale dans les muqueuses des voies aériennes, par le biais des IgA et des cellules dendritiques (qui présentent les antigènes aux lymphocytes T).
La surprise est venue lorsque des chercheurs ont inoculé des souris génétiquement modifiées pour n'avoir qu'une seule forme d'immunité. Pour le SARS-CoV-1, comme pour le MERS-CoV, les souris dépourvues d'immunité cellulaire ne parviennent pas à éliminer le virus et souffrent d'une forte mortalité malgré la production d'anticorps neutralisants. Mais celles dépourvues d'immunité humorale y parviennent aussi bien que des souris normales. L'immunité cellulaire est donc indispensable à l'élimination de ces CoV (ce qui, pour autant, ne rend pas inutile l'immunité humorale).
La mémoire immunitaire aux CoV : une affaire cellulaire
Plusieurs études se sont penchées sur la persistance de l'immunité spécifique après une infection par le SARS-CoV-1 ou le MERS-CoV. Concernant le SARS-CoV-1, 8 ans après l'infection, une étude portant sur une vingtaine de patients a montré une disparition complète des anticorps neutralisants spécifiques, mais aussi des lymphocytes B mémoire responsables de leur synthèse. Néanmoins, des lymphocytes T activement réactifs au SARS-CoV-1 ont été détectés jusqu'à 11 ans après la maladie, en particulier chez les personnes ayant souffert de formes sévères de l'infection.
Dans le cas du MERS-CoV, des anticorps neutralisants spécifiques ont été mesurés jusqu'à 34 mois après l'infection, mais on dispose de moins de recul qu'avec le SRAS. On ignore encore la durée de persistance de l'immunité cellulaire après un épisode de MERS. Ces résultats, pour préliminaires qu'ils soient, montre clairement l'importance de la mobilisation de l'immunité cellulaire dans une tentative de vaccination durable.
La sénescence de l'immunité cellulaire, un facteur de la vulnérabilité des personnes âgées ?
Une autre observation semble également pointer l'hypothèse d'un rôle central de l'immunité cellulaire dans l'élimination des CoV : la surmortalité observée chez les personnes (et les souris) âgées que ce soit pour le SRAS, le MERS ou la COVID-19. Certes, cette mortalité trouve également sa cause dans les pathologies intercurrentes plus fréquentes dans cette population. Mais les immunologistes font remarquer que l'âge exerce divers effets négatifs sur l'immunité : diminution du répertoire des cellules naïves B et T, moins bonne présentation des antigènes, récepteurs de type Toll moins fonctionnels (les TLR, chargés de reconnaître les motifs conservés entre différentes souches d'un même pathogène), baisse des capacités de migration des cellules dendritiques des voies respiratoires, etc.
De fait, l'administration de lymphocytes T issus de jeunes souris à des souris âgées infectées par le SARS-CoV-1 augmente significativement leur taux de survie, ce qui pourrait illustrer le rôle d'une baisse de l'immunité cellulaire dans la surmortalité des sujets âgés. Mais notons que l'administration d'anticorps neutralisants spécifiques peut également augmenter la survie de souris âgées infectées par SARS-CoV-1.
Des données récentes sur la réponse immunitaire pendant la COVID-19
Le 6 avril 2020, une étude a été mise en ligne (préprint, sans relecture par un comité) sur la réponse immunitaire humorale pendant la COVID-19, mesurée chez 175 patients (15-85 ans) atteints de formes légères de l'infection. Dix à 15 jours après le début des symptômes, la plupart des patients ont développé des anticorps neutralisants (dirigés contre les protéines S1, S2 et le RBD - receptor binding domain, la zone de la protéine S qui se fixe au récepteur cellulaire). Ces anticorps ne neutralisaient pas SARS-CoV-1. Environ 30 % des patients n'ont développé que des taux faibles d'anticorps neutralisants, et pour 10 patients, ce taux était en dessous du seuil de détectabilité.
Un point intéressant de cette étude est la différence de réponse immunitaire entre les 15-39 ans et les 40-59 ou les 60-85 ans. Ces deux derniers groupes avaient des taux sanguins d'anticorps neutralisants significativement plus élevés que les 15-39 ans, mais avaient des taux sanguins de lymphocytes significativement plus faibles. Ainsi, il se pourrait que la réponse humorale soit plus intense lorsque l'immunité cellulaire est moins performante (avec une possible corrélation avec la plus grande vulnérabilité des personnes âgées). À l'inverse, chez les patients les plus jeunes, la plus grande réactivité de l'immunité cellulaire rendrait moins essentielle la réponse humorale.
Stimuler l'immunité humorale : l'écueil des anticorps facilitants
Lorsque des immunologistes parlent de recherche vaccinale contre les CoV, le spectre des anticorps dits "facilitants" fait immédiatement naître un frisson d'anxiété. Ces anticorps (généralement des IgG, également appelés "non neutralisants") apparaissent après une première infection (ou une vaccination, par exemple dans le cas de la PIF ou de la dengue) et ont la fâcheuse particularité d'amener les virus qu'ils sont censés combattre directement au contact de cellules immunitaires… que ces mêmes virus s'empressent d'infecter, aggravant ainsi l'infection. Des anticorps facilitants ont été identifiés dans la dengue, la grippe, l'infection par le VIH/sida, Ebola et… le SRAS, entre autres. Dans le SRAS, ce n'est que 8 ans après l'épisode de 2003 que ces anticorps ont été mis en évidence.
Chez la souris, lors de tentatives de vaccination contre le SARS-CoV-1, le challenge post-vaccination fait apparaître des anticorps facilitants qui sont responsables d'hépatite, d'une augmentation de la morbidité et de l'intensification de la réaction inflammatoire. Ils pourraient également être impliqués dans l'apparition d'un choc cytokinique.
À ce jour, l'existence d'anticorps facilitants n'a pas été mise en évidence dans l'infection par le MERS-CoV, ni dans la réaction immunitaire à la suite d'un essai vaccinal contre ce CoV. Mais il est peut-être trop tôt pour éliminer définitivement cette possibilité.
Stimuler l'immunité humorale sans provoquer l'apparition d'anticorps facilitants
On sait désormais que, dans le cas de la vaccination contre le SRAS, l'apparition d'anticorps facilitants est plus fréquente lorsque l'antigène utilisé est la protéine S (spike protein, celle de la couronne du coronavirus) dans son intégralité. Pour prévenir cet effet indésirable, il existe deux stratégies :
- le masquage des épitopes qui déclenchent la production d'anticorps facilitants par une glycosylation bien ciblée ;
- l'"immunofocusing", c'est-à-dire l'usage d'épitopes qui déclenchent uniquement la production d'anticorps neutralisants.
Dans le contexte SRAS et MERS, la seconde stratégie a donné de bons résultats : l'utilisation du RBD comme antigène produit la meilleure réponse neutralisante sans déclencher de réponse facilitante. Mais cette zone est assez variable entre les souches de virus, ce qui complique la mise au point d'un vaccin largement efficace. De plus, comme indiqué précédemment, les immunologistes doutent de plus en plus de l'efficacité d'une vaccination purement humorale, tant en terme de qualité de la protection qu'en terme de durée de l'immunité.
Comment stimuler l'immunité cellulaire (en particulier locale) ?
Si la recherche vaccinale contre le SARS-CoV-1 s'est un peu éteinte à la suite de la disparition de cette infection, celle visant le MERS-CoV est toujours très active et c'est dans ce domaine qu'ont eu lieu les avancées les plus récentes.
Des chercheurs ont particulièrement travaillé sur l'immunogénicité d'un peptide inclus dans la nucléoprotéine N du MERS-CoV (également appelée nucléocapside) : il s'agit du peptide N353 (également appelé N353-367). Les 15 acides aminés qui composent ce peptide immunogénique sont "relativement conservés" entre le MERS-CoV et le SARS-CoV-1. Entre SARS-CoV-1 et SARS-CoV-2, une recherche dans les bases ViralZone et Uniprot montre que ce peptide est "strictement conservé" entre ces deux virus.
Dans le contexte du MERS-CoV, l'administration de ce peptide par voie intranasale à des souris produit une réponse immunitaire cellulaire solide avec apparition de lymphocytes T spécifiques dans les voies aériennes (plutôt que dans le parenchyme pulmonaire ou les vaisseaux sanguins locaux, deux localisations qui sont moins "en première ligne"). Lors de challenge viral par MERS-CoV ou par SARS-CoV-1, ces lymphocytes T sécrètent des quantités significatives d'interféron gamma, une cytokine clé de la réponse cellulaire. À ce jour, cet épitope semble le plus prometteur en termes de stimulation croisée de la réponse cellulaire contre MERS-CoV et SARS-CoV-1.
Le fait que la séquence correspondante à N353 soit strictement conservée entre SARS-CoV-1 et SARS-CoV-2 ouvre la voie à l'exploration de l'efficacité de cet épitope dans la vaccination contre la COVID-19.
Les essais vaccinaux actuels contre la COVID-19 explorent-ils ces pistes ?
À la lumière des connaissances actuelles sur le rôle des différentes immunités dans la réponse aux infections à CoV, il semble qu'un bon vaccin candidat devra à la fois stimuler la réponse humorale (sans déclencher d'anticorps facilitants, par exemple en utilisant le RBD pangolinesque du SARS-CoV-2) et la réponse cellulaire (en particulier la réponse locale au niveau des muqueuses, mais pas seulement, par exemple avec N353).
Dans une revue des développements vaccinaux en cours contre la COVID-19, publiée le 9 avril 2020 dans Nature Reviews, 115 vaccins candidats sont signalés, dont 78 en développement actif confirmé. À la même date, 8 essais cliniques vaccinaux sont listés parmi les 410 essais relatifs à la COVID-19 dans la base ClinicalTrials.gov.
Cinq vaccins en cours d'étude clinique sont centrés sur la protéine S, parfois dans son intégralité, sous la forme d'ADN ou d'ARNm codant pour cette protéine : mRNA-1273, Ad5-nCoV, bacTRL-spike, ChAdOx1-nCoV-19 et INO4800. Ce choix de la protéine S intégrale comme antigène pose la question de la production d'anticorps facilitants. Concernant INO4800, un vaccin similaire, INO4700 contre le MERS-CoV, a été testé en phase I avec production d'anticorps neutralisants pendant au moins 60 semaines et une réponse cellulaire "large", mais sans information sur d'éventuels anticorps facilitants.
D'autres vaccins à l'étude ("vaccins minigènes", aAPC et LV-SMENP-DC) tablent sur des "gènes multiples", mais les promoteurs ne sont pas diserts sur les gènes/épitopes utilisés.
Concernant le vaccin recombinant utilisant le virus de la rougeole comme vecteur, développé par l'Institut Pasteur, Themis Bioscience et l'université de Pittsburgh, les épitopes concernés n'ont pas encore été choisis. Ainsi, pour l'instant, aucun essai clinique en cours n'utilise ouvertement le RBD ou N353 comme épitopes.
En conclusion, il reste encore beaucoup de chemin à faire dans la compréhension de l'immunité contre les CoV, en particulier celle relative à la production d'une mémoire immunitaire durable. L'absence de succès vaccinaux flagrants avec le MERS-CoV (et avec le SARS-CoV-1 jusqu'à sa sortie du périmètre d'intérêt des chercheurs) n'est pas encourageante, d'autant plus que les vaccins actuellement à l'étude semblent davantage centrés sur la production d'anticorps neutralisants que sur la stimulation de l'immunité cellulaire, en particulier locale. Et ce en dépit des enseignements obtenus en étudiant le SRAS ou le MERS, ou de ceux issus de la recherche récente sur la réponse immunitaire face au SARS-CoV-2.
(Edit du 20 avril 2020) Des chercheurs du NIH viennent de rendre publics les résultats d'un essai du vaccin ChAdOX1 (protéine S du MERS-CoV portée par un adénovirus du chimpanzé) contre le MERS. Le vaccin a été administré à 3 groupes de 6 macaques, dont un groupe contrôle. Les deux protocoles choisis étaient soit une vaccination unique 28 jours avant le challenge viral, soit une double administration 56 jours puis 28 jours avant le challenge viral. Les deux groupes expérimentaux ont été protégés de l'apparition de symptômes, avec une forte réduction de la charge virale pulmonaire. De plus, aucun signe de réplication virale n'a été détecté dans le groupe doublement vacciné. In vitro, les anticorps obtenus neutralisent 6 souches de MERS-CoV. Aucune donnée n'a été publiée sur la présence éventuelle d'anticorps facilitants, ni sur la réaction à un challenge viral plus tardif. Un essai de phase 1 avec ce vaccin est actuellement mené chez l'homme au Royaume-Uni et en Arabie saoudite.
(Edit du 3 juin 2020) Le préprint d'une étude singapourienne, publié le 27 mai 2020, a observé, chez 24 personnes qui avaient souffert de SRAS, la persistance d'une immunité cellulaire (CD4 et CD8) contre le virus du SRAS 17 ans après la maladie. Cette immunité cellulaire était dirigée contre des épitopes issus de la nucléoprotéine NP du SARS-CoV-1, mais aussi contre la nucléoprotéine du SARS-CoV-2, conférant ainsi une forme d'immunité croisée.
Il semble de plus en plus probable que la nucléoprotéine coronavirale soit une bonne source d'épitopes pour le développement d'un vaccin contre la Covid-19, qui serait ainsi probablement efficace contre le SARS et le MERS.
Merci à Mohamed Ouizougun-Oubari, virologiste travaillant sur les nucléoprotéines, pour la discussion autour de N353, la recherche des séquences de N353 dans ViralZone et Uniprot, l'alignement des séquences des 3 CoV dans Blast, et l'illustration originale de cet article.
©vidal.fr
Pour aller plus loin
Une synthèse des connaissances sur les vaccins contre le MERS
Okba NMA, Raj VS et Haagmans BL. « Middle East respiratory syndrome coronavirus vaccines: current status and novel approaches. » Curr Opin Virol. 2017 Apr; 23: 49–58.
L'article qui montre que seule l'immunité cellulaire est indispensable lors de SRAS
Zhao J, Zhao J et Perlman S. « T Cell Responses Are Required for Protection from Clinical Disease and for Virus Clearance in Severe Acute Respiratory Syndrome Coronavirus-Infected Mice. » Journal of Virology, Sept. 2010, p. 9318–9325 Vol. 84
L'étude sur l'absence de mémoire humorale 8 ans après un épisode de SRAS
Tang F, Quan Y, Xin ZT et al. « Lack of Peripheral Memory B Cell Responses in Recovered Patients with Severe Acute Respiratory Syndrome: A Six-Year Follow-Up Study. » The Journal of Immunology, 2011, 186: 7264–7268.
L'étude sur la réponse immunitaire lors de COVID-19
Wu F, Wang A, Liu M et al. « Neutralizing antibody responses to SARS-CoV-2 in a COVID-19 recovered patient cohort and their implications. » MedRxiv, 6 avril 2020
Ce que l'on sait du rôle des anticorps facilitants dans la dengue (et une bonne synthèse des connaissances sur ces anticorps)
Halstead SB. « Dengue Antibody-Dependent Enhancement: Knowns and Unknowns. » Microbiol Spectr. 2014 Dec;2(6).
Un article sur le rôle des anticorps facilitants dans le SRAS
Yip MS, Leung HL, Li PH et al. « Antibody-dependent enhancement of SARS coronavirus infection and its role in the pathogenesis of SARS. » Hong Kong Med J, Volume 22 Number 3 (Supplement 4), june 2016
L'article sur l'usage du peptide N353 pour déclencher l'immunité cellulaire locale (MERS) et sur l'influence de l'âge sur la réaction immunitaire cellulaire
Zhao J, Zhao J, Mangalam AK et al. « Airway Memory CD4+ T Cells Mediate Protective Immunity against Emerging Respiratory Coronaviruses. » Immunity, Volume 44, Issue 6, 21 June 2016, Pages 1379-1391
Notre article traitant du RBD du SARS-CoV-2
« La clé parfaite du pangolin : voyage aux origines du SARS-CoV-2 », VIDAL News, 3 avril 2020
Deux synthèses sur la recherche vaccinale COVID-19 en cours
Le TT, Andreadakis Z, Kumar A et al. « The COVID-19 vaccine development landscape. » Nature Reviews, 9 avril 2020
Liu C, Zhou Q, Li Y et al. « Research and Development on Therapeutic Agents and Vaccines for COVID-19 and Related Human Coronavirus Diseases. » ACS Cent. Sci. 2020, 6, 3, 315-331
Comment stimuler l'immunité cellulaire (en particulier locale) ?
Si la recherche vaccinale contre le SARS-CoV-1 s'est un peu éteinte à la suite de la disparition de cette infection, celle visant le MERS-CoV est toujours très active et c'est dans ce domaine qu'ont eu lieu les avancées les plus récentes.
Des chercheurs ont particulièrement travaillé sur l'immunogénicité d'un peptide inclus dans la nucléoprotéine N du MERS-CoV (également appelée nucléocapside) : il s'agit du peptide N353 (également appelé N353-367). Les 15 acides aminés qui composent ce peptide immunogénique sont "relativement conservés" entre le MERS-CoV et le SARS-CoV-1. Entre SARS-CoV-1 et SARS-CoV-2, une recherche dans les bases ViralZone et Uniprot montre que ce peptide est "strictement conservé" entre ces deux virus.
Dans le contexte du MERS-CoV, l'administration de ce peptide par voie intranasale à des souris produit une réponse immunitaire cellulaire solide avec apparition de lymphocytes T spécifiques dans les voies aériennes (plutôt que dans le parenchyme pulmonaire ou les vaisseaux sanguins locaux, deux localisations qui sont moins "en première ligne"). Lors de challenge viral par MERS-CoV ou par SARS-CoV-1, ces lymphocytes T sécrètent des quantités significatives d'interféron gamma, une cytokine clé de la réponse cellulaire. À ce jour, cet épitope semble le plus prometteur en termes de stimulation croisée de la réponse cellulaire contre MERS-CoV et SARS-CoV-1.
Le fait que la séquence correspondante à N353 soit strictement conservée entre SARS-CoV-1 et SARS-CoV-2 ouvre la voie à l'exploration de l'efficacité de cet épitope dans la vaccination contre la COVID-19.
Les essais vaccinaux actuels contre la COVID-19 explorent-ils ces pistes ?
À la lumière des connaissances actuelles sur le rôle des différentes immunités dans la réponse aux infections à CoV, il semble qu'un bon vaccin candidat devra à la fois stimuler la réponse humorale (sans déclencher d'anticorps facilitants, par exemple en utilisant le RBD pangolinesque du SARS-CoV-2) et la réponse cellulaire (en particulier la réponse locale au niveau des muqueuses, mais pas seulement, par exemple avec N353).
Dans une revue des développements vaccinaux en cours contre la COVID-19, publiée le 9 avril 2020 dans Nature Reviews, 115 vaccins candidats sont signalés, dont 78 en développement actif confirmé. À la même date, 8 essais cliniques vaccinaux sont listés parmi les 410 essais relatifs à la COVID-19 dans la base ClinicalTrials.gov.
Cinq vaccins en cours d'étude clinique sont centrés sur la protéine S, parfois dans son intégralité, sous la forme d'ADN ou d'ARNm codant pour cette protéine : mRNA-1273, Ad5-nCoV, bacTRL-spike, ChAdOx1-nCoV-19 et INO4800. Ce choix de la protéine S intégrale comme antigène pose la question de la production d'anticorps facilitants. Concernant INO4800, un vaccin similaire, INO4700 contre le MERS-CoV, a été testé en phase I avec production d'anticorps neutralisants pendant au moins 60 semaines et une réponse cellulaire "large", mais sans information sur d'éventuels anticorps facilitants.
D'autres vaccins à l'étude ("vaccins minigènes", aAPC et LV-SMENP-DC) tablent sur des "gènes multiples", mais les promoteurs ne sont pas diserts sur les gènes/épitopes utilisés.
Concernant le vaccin recombinant utilisant le virus de la rougeole comme vecteur, développé par l'Institut Pasteur, Themis Bioscience et l'université de Pittsburgh, les épitopes concernés n'ont pas encore été choisis. Ainsi, pour l'instant, aucun essai clinique en cours n'utilise ouvertement le RBD ou N353 comme épitopes.
En conclusion, il reste encore beaucoup de chemin à faire dans la compréhension de l'immunité contre les CoV, en particulier celle relative à la production d'une mémoire immunitaire durable. L'absence de succès vaccinaux flagrants avec le MERS-CoV (et avec le SARS-CoV-1 jusqu'à sa sortie du périmètre d'intérêt des chercheurs) n'est pas encourageante, d'autant plus que les vaccins actuellement à l'étude semblent davantage centrés sur la production d'anticorps neutralisants que sur la stimulation de l'immunité cellulaire, en particulier locale. Et ce en dépit des enseignements obtenus en étudiant le SRAS ou le MERS, ou de ceux issus de la recherche récente sur la réponse immunitaire face au SARS-CoV-2.
(Edit du 20 avril 2020) Des chercheurs du NIH viennent de rendre publics les résultats d'un essai du vaccin ChAdOX1 (protéine S du MERS-CoV portée par un adénovirus du chimpanzé) contre le MERS. Le vaccin a été administré à 3 groupes de 6 macaques, dont un groupe contrôle. Les deux protocoles choisis étaient soit une vaccination unique 28 jours avant le challenge viral, soit une double administration 56 jours puis 28 jours avant le challenge viral. Les deux groupes expérimentaux ont été protégés de l'apparition de symptômes, avec une forte réduction de la charge virale pulmonaire. De plus, aucun signe de réplication virale n'a été détecté dans le groupe doublement vacciné. In vitro, les anticorps obtenus neutralisent 6 souches de MERS-CoV. Aucune donnée n'a été publiée sur la présence éventuelle d'anticorps facilitants, ni sur la réaction à un challenge viral plus tardif. Un essai de phase 1 avec ce vaccin est actuellement mené chez l'homme au Royaume-Uni et en Arabie saoudite.
(Edit du 3 juin 2020) Le préprint d'une étude singapourienne, publié le 27 mai 2020, a observé, chez 24 personnes qui avaient souffert de SRAS, la persistance d'une immunité cellulaire (CD4 et CD8) contre le virus du SRAS 17 ans après la maladie. Cette immunité cellulaire était dirigée contre des épitopes issus de la nucléoprotéine NP du SARS-CoV-1, mais aussi contre la nucléoprotéine du SARS-CoV-2, conférant ainsi une forme d'immunité croisée.
Il semble de plus en plus probable que la nucléoprotéine coronavirale soit une bonne source d'épitopes pour le développement d'un vaccin contre la Covid-19, qui serait ainsi probablement efficace contre le SARS et le MERS.
Merci à Mohamed Ouizougun-Oubari, virologiste travaillant sur les nucléoprotéines, pour la discussion autour de N353, la recherche des séquences de N353 dans ViralZone et Uniprot, l'alignement des séquences des 3 CoV dans Blast, et l'illustration originale de cet article.
©vidal.fr
Pour aller plus loin
Une synthèse des connaissances sur les vaccins contre le MERS
Okba NMA, Raj VS et Haagmans BL. « Middle East respiratory syndrome coronavirus vaccines: current status and novel approaches. » Curr Opin Virol. 2017 Apr; 23: 49–58.
L'article qui montre que seule l'immunité cellulaire est indispensable lors de SRAS
Zhao J, Zhao J et Perlman S. « T Cell Responses Are Required for Protection from Clinical Disease and for Virus Clearance in Severe Acute Respiratory Syndrome Coronavirus-Infected Mice. » Journal of Virology, Sept. 2010, p. 9318–9325 Vol. 84
L'étude sur l'absence de mémoire humorale 8 ans après un épisode de SRAS
Tang F, Quan Y, Xin ZT et al. « Lack of Peripheral Memory B Cell Responses in Recovered Patients with Severe Acute Respiratory Syndrome: A Six-Year Follow-Up Study. » The Journal of Immunology, 2011, 186: 7264–7268.
L'étude sur la réponse immunitaire lors de COVID-19
Wu F, Wang A, Liu M et al. « Neutralizing antibody responses to SARS-CoV-2 in a COVID-19 recovered patient cohort and their implications. » MedRxiv, 6 avril 2020
Ce que l'on sait du rôle des anticorps facilitants dans la dengue (et une bonne synthèse des connaissances sur ces anticorps)
Halstead SB. « Dengue Antibody-Dependent Enhancement: Knowns and Unknowns. » Microbiol Spectr. 2014 Dec;2(6).
Un article sur le rôle des anticorps facilitants dans le SRAS
Yip MS, Leung HL, Li PH et al. « Antibody-dependent enhancement of SARS coronavirus infection and its role in the pathogenesis of SARS. » Hong Kong Med J, Volume 22 Number 3 (Supplement 4), june 2016
L'article sur l'usage du peptide N353 pour déclencher l'immunité cellulaire locale (MERS) et sur l'influence de l'âge sur la réaction immunitaire cellulaire
Zhao J, Zhao J, Mangalam AK et al. « Airway Memory CD4+ T Cells Mediate Protective Immunity against Emerging Respiratory Coronaviruses. » Immunity, Volume 44, Issue 6, 21 June 2016, Pages 1379-1391
Notre article traitant du RBD du SARS-CoV-2
« La clé parfaite du pangolin : voyage aux origines du SARS-CoV-2 », VIDAL News, 3 avril 2020
Deux synthèses sur la recherche vaccinale COVID-19 en cours
Le TT, Andreadakis Z, Kumar A et al. « The COVID-19 vaccine development landscape. » Nature Reviews, 9 avril 2020
Liu C, Zhou Q, Li Y et al. « Research and Development on Therapeutic Agents and Vaccines for COVID-19 and Related Human Coronavirus Diseases. » ACS Cent. Sci. 2020, 6, 3, 315-331
Sources
Pour recevoir gratuitement toute l’actualité par mail Je m'abonne !

 11 minutes
11 minutes 15 commentaires
15 commentaires 


Commentaires
Cliquez ici pour revenir à l'accueil.