
Impression visuelle, telle qu’elle se présente approximativement avec un scotome central relatif (illustration @Ralf Roletschek sur Wikimedia).
Des difficultés pour actionner le piston de certaines seringues pré-remplies de LUCENTIS 10 mg/mL solution injectable en seringue préremplie ont été rapportées par des professionnels de santé de plusieurs pays.
Dans une lettre aux professionnels de santé en date du 11 septembre 2019, le laboratoire Novartis indique que "les réclamations concernent un nombre restreint de seringues, provenant de certains lots, et une investigation est actuellement en cours".
Ce dysfonctionnement du dispositif d'injection expose les patients à une administration incomplète de la dose de ranibizumab et, par conséquent, à une perte d'efficacité de LUCENTIS (Cf. Encadré 1).
Dans ce contexte, le laboratoire informe les professionnels de santé sur la conduite à tenir en présence d'un tel dysfonctionnement.
Encadré 1 - Indications thérapeutiques de LUCENTIS
LUCENTIS est indiqué chez les adultes dans :
|
Identifier le dysfonctionnement lors de la préparation de la dose
Lors de la préparation de la dose, avant l'injection de LUCENTIS, il est recommandé de vérifier systématiquement que "le piston de la seringue pré-remplie puisse être poussé librement et facilement jusqu'à l'ajustement de la dose".
En effet, la seringue préremplie de LUCENTIS (Cf. Figure 1) contient une dose de produit supérieure à la dose recommandée de 0,5 mg. Le volume excédentaire doit être éliminé avant l'injection, en poussant le piston lentement jusqu'au repère de dose indiqué sur le corps de la seringue (trait de dose noir). Le volume à injecter est de 0,05 mL de solution, équivalent à 0,5 mg de ranibizumab.
Figure 1 - Descriptif de la seringue préremplie de LUCENTIS
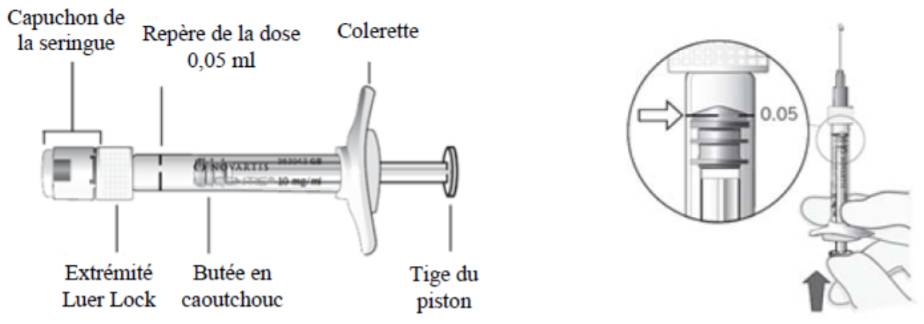
En cas de difficultés à actionner le piston de la seringue
Si le piston montre une résistance à la poussée, l'injection ne doit pas être réalisée : une nouvelle seringue pré-remplie doit être utilisée en remplacement.
Si l'injection a débuté lorsque le dysfonctionnement est identifié, il est recommandé d'arrêter l'injection.
En cas d'injection d'une dose incomplète de LUCENTIS
Si une dose incomplète, c'est-à-dire inférieure à la dose recommandée de 0,05 mL, est injectée au patient, une diminution de l'efficacité du traitement peut être observée.
Dans cette situation, il est recommandé de contrôler l'efficacité du traitement selon les pratiques cliniques habituelles.
Il conviendra notamment de suivre les recommandations concernant les intervalles de traitement pour les injections de LUCENTIS, en tenant compte d'un intervalle minimal de 4 semaines entre 2 injections consécutives dans le même œil, comme décrit dans la rubrique "Posologie et mode d'administration" de la monographie VIDAL de LUCENTIS.
Une réinjection au cours d'une même séance ne doit être envisagée qu'en cas d'absolue nécessité pour le patient et après avoir évalué le risque de surdosage (Cf. Encadré 2).
Encadré 2 - Risques liés au surdosage de LUCENTIS
| Des cas de surdosage accidentels ont été rapportés au cours des essais cliniques dans la DMLA néovasculaire et après la mise sur le marché. Les effets indésirables associés à ces cas étaient :
En cas de surdosage, la pression intraoculaire doit être surveillée et traitée si nécessaire par l'ophtalmologiste présent. |
Modalité de retour d'une seringue défecteuse
Toute seringue présentant des difficultés d'utilisation doit être retournée à Novartis pour notification et évaluation de l'éventuel défaut.
Pour les modalités de retour, le laboratoire indique de contacter le département d'Information et Communication Médicale au +33 (0)1 55 47 66 00 ou icm.phfr@novartis.com.
Pour aller plus loin
Lucentis (ranibizumab) : recommandations en cas de difficulté pour actionner le piston des seringues pré-remplies (ANSM, 11 septembre 2019)
Lettre du laboratoire aux ophtalmologistes et pharmaciens - Recommandations relatives à LUCENTIS (sur le site de l'ANSM, septembre 2019)
Pour aller plus loin
Consultez les monographies VIDAL
Sources
Pour recevoir gratuitement toute l’actualité par mail Je m'abonne !

 3 minutes
3 minutes Ajouter un commentaire
Ajouter un commentaire


Commentaires
Cliquez ici pour revenir à l'accueil.