Cliché d'un fond d'oeil montrant des lésions de rétinopathie diabétique (ilustration).
ILUVIEN 190 µg implant intravitréen est le premier médicament indiqué dans le traitement de la perte d'acuité visuelle associée aux formes chroniques d'œdème maculaire diabétique (OMD) et en échec aux traitements disponibles (photocoagulation au laser, ranibizumab) [Cf. VIDAL Recos "Diabète de type 1" et "Diabète de type 2 : suivi au long cours"].
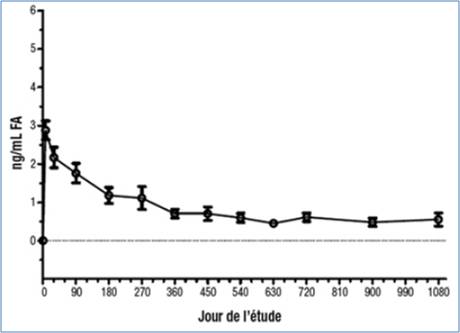
Son principe actif, le flucinolone acétonide (AcF), est un corticoïde dont la libération est progressive, sur une période allant jusqu'à 36 mois (Cf. Figure 1).
Figure 1 - Concentrations de l'AcF dans l'humeur aqueuse humaine chez des sujets ayant reçu 1 implant ILUVIEN (étude FAMOUS)
SMR modéré, ASMR mineure
Dans son avis du 26 juin 2013, la Commission de la Transparence a évalué l'efficacité et la tolérance d'ILUVIEN sur la base de deux études de même protocole, randomisées en double aveugle versus placebo (injection simulée), FAME A et FAME B.
Les patients inclus présentaient une baisse d'acuité visuelle liée à un œdème maculaire diabétique (OMD) précédemment traité au moins une fois par photocoagulation au laser.
Les patients pouvaient être à nouveau traités à la même dose (0,2 µg/jour [posologie de l'AMM] ou 0,5 µg/jour) en cas d'aggravation entre les 12e et 33e mois [perte de vision > ou = 5 lettres ETDRS (Early Treatment Diabetic Retinopathy Study) ou épaississement de la rétine > ou = 50 µm visible à la tomographie par cohérence optique au centre de la fovéa, comparativement au meilleur statut du patient au cours des 12 mois précédents).
En l'absence d'amélioration, les patients pouvaient être traités par laser, à l'appréciation de l'investigateur, en respectant un intervalle de 6 semaines après ILUVIEN.
Les corticoïdes intravitréens (hors autorisation de mise sur le marché) et les anti-VEGF ne devaient pas être utilisés.
Le critère principal d'évaluation de l'efficacité d'ILUVIEN était le pourcentage de patients ayant obtenu un gain de meilleure acuité visuelle corrigée (MAVC) d'au moins 15 lettres après 24 mois.
Une analyse en sous-groupe a été réalisée en fonction du caractère chronique (durée > ou = 3 ans) ou non de l'OMD.
La durée de suivi était de 3 ans pour chaque patient.
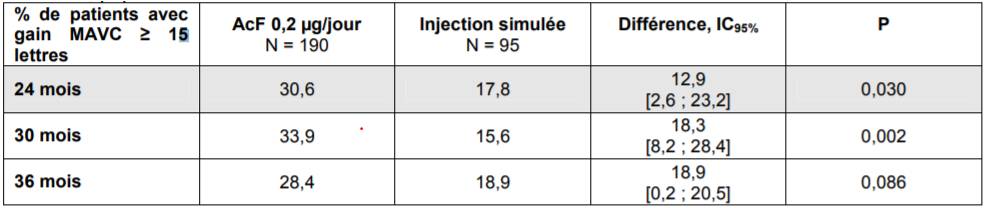
Selon les résultats de ces études, le pourcentage de patients ayant eu un gain de MAVC > ou = 15 lettres après 24 mois a été plus élevé avec l'AcF 0,2 µg/j (posologie de l'AMM) qu'avec le placebo : 26,8 % versus 14,7 % (p = 0,029) dans l'étude FAME A et 30,6 % versus 17,8 % (p = 0,030) dans l'étude FAME B (Cf. Tableaux I et II).
Cette supériorité s'est maintenue après 30 mois, mais pas après 36 mois.
Tableau I - Résultats sur le pourcentage de patients ayant un gain de MAVC > ou = 15 lettres (ETDRS) - étude FAME A, population FAS-LOCF
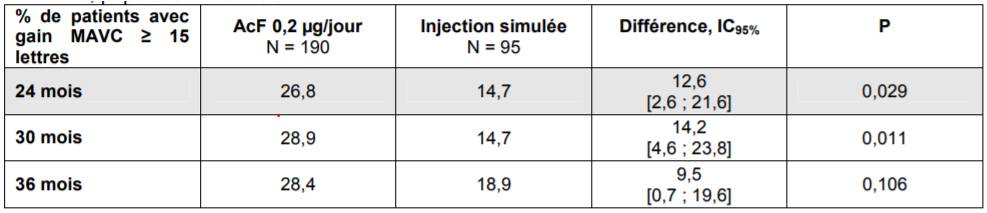
Tableau II - Résultats sur le pourcentage de patients ayant un gain de MAVC > ou = 15 lettres (ETDRS) – étude FAME B, population FAS-LOCF
S'agissant du sous-groupe des patients ayant un OMD chronique (> ou = 3 ans), le pourcentage de patients ayant eu un gain de MAVC > ou = 15 lettres après 24 mois a été plus élevé avec l'AcF 0,2 µg/j qu'avec le placebo dans l'étude FAME A et dans l'étude FAME B :
- FAME A : 31,8 % versus 11,9 %, soit une différence de 20,0 % (p = 0,004),
- FAME B : 37,4 % versus 15,1 %, soit une différence de 22,3 % (p = 0,006).
En termes de tolérance, le pourcentage d'événements indésirables liés au traitement a été plus élevé avec l'AcF 0,2 µg/j qu'avec le placebo : 70 % vs 30 %. Ces événements indésirables étaient principalement ceux habituellement observés avec les corticoïdes par voie intravitréenne tels une cataracte, une augmentation de la pression intraoculaire dans l'œil étudié, une myodésopsie, une infection de l'œil.
La Commission fait remarquer que "ces résultats doivent être interprétés avec réserve dans la mesure où, dans les deux études, une part importante des patients a arrêté l'étude prématurément (30 %) ou utilisé des traitements interdits pouvant avoir une efficacité sur l'OMD (10 à 20 % environ dans les groupes acétonide de fluocinolone et 30 à 35 % dans les groupes placebo). De plus, ces études n'ayant pas été réalisées chez des patients en échec du ranibizumab, la Commission n'a pas pu apprécier son intérêt dans cette population, bien qu'elle soit incluse dans l'indication de l'AMM d'ILUVIEN".
Considérant l'ensemble de ces données, la Commission a attribué à ILUVIEN un service médical rendu (SMR) modéré et une amélioration du SMR mineure (ASMR IV).
Elle considère que cette spécialité est un traitement de dernière intention de la baisse d'acuité visuelle liée à un OMD chronique lorsque la réponse aux autres traitements disponibles est jugée insuffisante (photocoagulation au laser, ranibizumab) et malgré l'optimisation de la prise en charge du diabète.
A ce stade de la maladie, il n'existe pas d'alternative thérapeutique à ILUVIEN.
ILUVIEN en pratique
ILUVIEN est administré par voie intravitréenne, à l'aide d'un applicateur à usage unique (Cf. Figure 2).
Figure 2 - ILUVIEN : applicateur (illustration @site du laboratoire Horus)
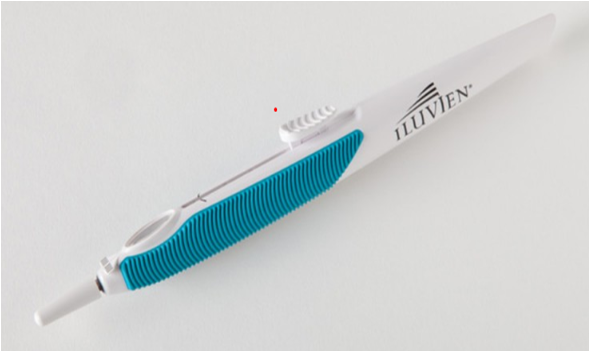
L'implant a une forme cylindrique mesurant environ 3,5 mm x 0,37 mm.
 Chaque implant contient 190 µg de flucinolone acétonide.
Chaque implant contient 190 µg de flucinolone acétonide.ILUVIEN doit être administré par un ophtalmologiste expérimenté dans les injections intravitréennes.
La procédure d'injection intravitréenne doit être réalisée en conditions d'asepsie contrôlées, incluant le port de gants stériles, l'utilisation d'un champ stérile et d'un blépharostat (ou équivalent) stérile.
Une anesthésie adéquate et une antisepsie antibactérienne à large spectre doivent être administrées avant l'injection.
La dose recommandée est 1 implant d'ILUVIEN dans l'œil atteint.
Elle est libérée pendant une durée d'environ 36 mois.
- Administration d'un second implant : attendre 12 mois
Si le patient présente une perte d'acuité visuelle ou une augmentation de l'épaisseur rétinienne secondaire à une récidive ou à une aggravation de l'œdème maculaire diabétique, il est recommandé d'attendre 12 mois avant d'administrer un second implant.
Un 2e traitement par ILUVIEN ne doit être envisagé que si les bénéfices potentiels sont supérieurs aux risques.
- Surveillance des patients
- endophtalmie,
- augmentation de la pression intraoculaire,
- décollement de la rétine et hémorragies,
- décollements vitréens.
Une biomicroscopie avec tonométrie doit être réalisée dans les 2 à 7 jours suivant l'injection de l'implant.
Ces contrôles doivent être poursuivis au moins une fois par trimestre afin de détecter l'apparition d'éventuelles complications.
Conseils aux patients
Le patient ne doit pas sortir ILUVIEN de son emballage (plaquette thermoformée) : la plaquette doit être ouverte juste avant l'utilisation de l'implant.
Identité administrative
- Liste I
- Prescription réservée aux spécialistes en ophtalmologie
- Boîte de 1 applicateur avec aiguille 25 G, CIP 3400922285818
- Remboursable à 30 % selon la procédure des médicaments d'exception : prescription en conformité avec la fiche d'information thérapeutique en vigueur (publiée au Journal officiel du 28 mars 2019 - texte 15)
- Prix public TTC = 6022,48 euros
- Agrément aux collectivités (Journal officiel du 28 mars 2019 - texte 16)
- Laboratoire Horus Pharma
Pour aller plus loin
Avis de la Commission de la Transparence - ILUVIEN (HAS, 26 juin 2013)
Pour aller plus loin
Consultez les monographies VIDAL
Sources
Pour recevoir gratuitement toute l’actualité par mail Je m'abonne !

 5 minutes
5 minutes Ajouter un commentaire
Ajouter un commentaire


Commentaires
Cliquez ici pour revenir à l'accueil.