Lésions de psoriasis sur les mains d'un patient (illustration).
TREMFYA 100 mg solution injectable est un nouvel anticorps monoclonal dont le principe actif, le guselkumab, est le premier inhibiteur sélectif de la voie de l'interleukine 23 (Cf. Encadré 1).
Encadré 1 - Mécanisme d'action du guselkumab
| Le guselkumab exerce ses effets cliniques sur le psoriasis en plaques par le blocage de la voie cytokinique de l'IL-23. L'IL-23, une cytokine régulatrice, agit sur la différenciation, l'expansion et la survie de certaines sous-populations de lymphocytes T (lymphocytes Th17 et Tc17, par exemple) et de certaines sous-populations de cellules de l'immunité innée, qui représentent des sources de cytokines effectrices, comprenant l'IL-17A, l'IL-17F et l'IL-22 impliquées dans l'inflammation. Chez l'Homme, il a été montré que le blocage sélectif de l'IL-23 permet de normaliser la production de ces cytokines. Les taux d'IL-23 sont élevés dans la peau des patients atteints de psoriasis en plaques. Dans les modèles in vitro, il a été montré que le guselkumab inhibe la bio-activité de l'IL-23 en bloquant son interaction avec le récepteur de surface cellulaire de l'IL-23, perturbant ainsi la signalisation, l'activation et la cascade cytokinique médiées par l'IL-23. |
TREMFYA est indiqué dans le traitement du psoriasis en plaques modéré à sévère chez l'adulte qui nécessite un traitement systémique (Cf. VIDAL Reco "Psoriasis en plaques de l'adulte").
 Il fait l'objet d'une surveillance supplémentaire qui permettra l'identification rapide de nouvelles informations relatives à la sécurité. Les professionnels de la santé déclarent tout effet indésirable suspecté.
Il fait l'objet d'une surveillance supplémentaire qui permettra l'identification rapide de nouvelles informations relatives à la sécurité. Les professionnels de la santé déclarent tout effet indésirable suspecté.
Dans son avis du 3 octobre 2018, la Commission de la Transparence a évalué TREMFYA sur la base principalement de 3 études de phase III randomisées en double aveugle, versus placebo et versus d'autres anticorps monoclonaux :
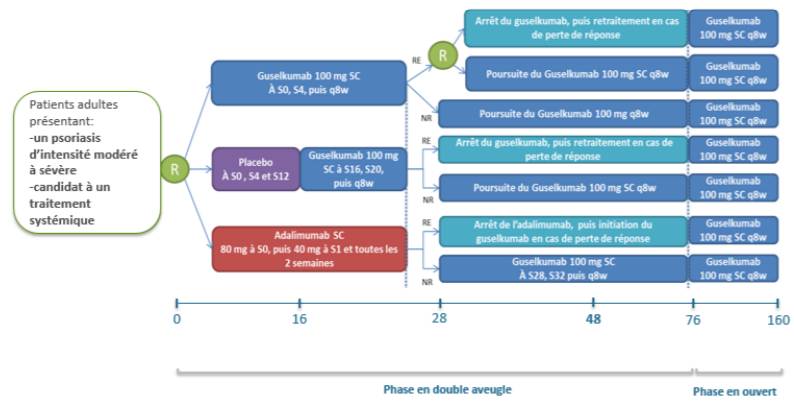
- les études VOYAGE 1 (n = 837) de 48 semaines et VOYAGE 2 (n = 992) de 28 semaines dans lesquelles le guselkumab a été comparé au placebo et à l'adalimumab (HUMIRA) chez des patients candidats à un traitement systémique ou la photothérapie. Ces études comportaient une phase de suivi ouverte jusqu'à 3 ans (Cf. Figures 1 et 2).
Figure 1 - Schéma de l'étude VOYAGE 1
(extrait de l'avis de la Commission de la Transparence sur TREMFYA, HAS 3 octobre 2018)
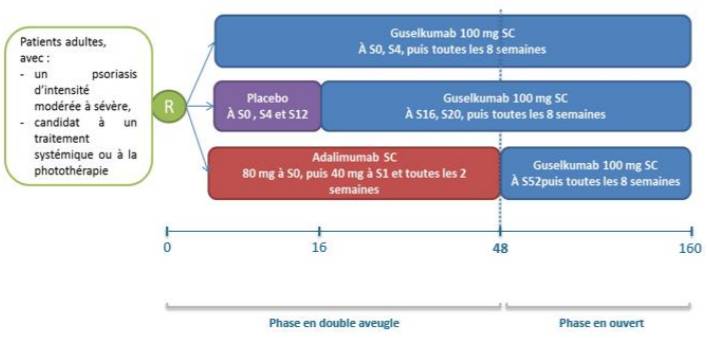 |
Figure 2 - Schéma de l'étude VOYAGE 2
(extrait de l'avis de la Commission de la Transparence sur TREMFYA, HAS 3 octobre 2018)
(extrait de l'avis de la Commission de la Transparence sur TREMFYA, HAS 3 octobre 2018)
 |
Les résultats de ces études ont montré la supériorité du guselkumab par rapport au placebo (analyse principale de l'étude) sur les deux co-critères de jugement principaux (p < 0,001) avec :
- des pourcentages de répondeurs avec lésions blanchies ou presque blanchies évaluées par le médecin [IGA (Investigator Gobal Assesment) 0 ou 1] de 85,1 % et 84,1 % dans le groupe guselkumab versus 6,9 % et 8,5 % dans le groupe placebo,
- des pourcentages de répondeurs PASI 90 (Psoriasis Area Severity Index) de 73,3 % et 70,0 % dans le groupe guselkumab versus 2,9 % et 2,4 % dans le groupe placebo ;
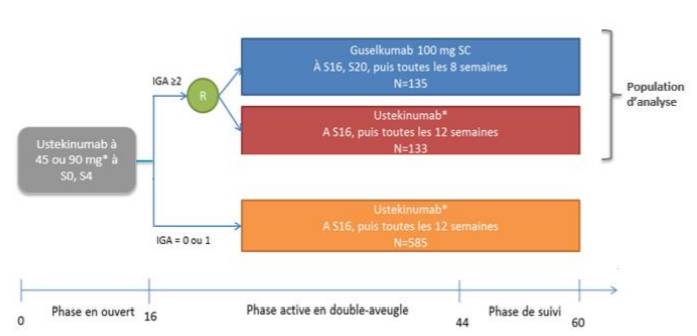
- l'étude NAVIGATE (n = 871), de 60 semaines, a comparé le guselkumab versus ustékinumab (STELARA), chez des patients adultes ayant un psoriasis en plaques modéré à sévère et ayant obtenu une réponse initiale insuffisante à l'ustékinumab après 16 semaines de traitement (Cf. Figure 3).
Figure 3 - Schéma de l'étude NAVIGATE
(extrait de l'avis de la Commission de la transparence sur TREMFYA, HAS 3 octobre 2018)
 |
** Gel de base et levée de l'aveugle pour la partie randomisée à la semaine 44.
Les résultats de cette étude ont montré la supériorité du guselkumab par rapport à l'ustékinumab en termes de réponse IGA de 0 ou 1 et une amélioration d'au moins 2 points du score entre les semaines 28 et 40 chez des patients ayant une réponse insuffisante à l'ustékinumab après un traitement de 16 semaines par ce dernier.
La Commission fait néanmoins remarquer que "cette étude n'est pas pertinente car selon la stratégie thérapeutique, après échec de l'ustékinumab, un autre traitement biologique aurait dû être mis en place".
En termes de tolérance, les effets indésirables les plus fréquents avec le guselkumab sont les suivants : infections des voies respiratoires supérieures, gastro-entérites, infections à Herpes simplex, dermatophytoses, céphalée, diarrhée, urticaire, arthralgie et érythème au site d'injection.
La Commission précise qu"'il existe un risque de réactions d'hypersensibilité graves nécessitant l'arrêt immédiat de l'administration de TREMFYA et l'instauration d'un traitement approprié".
SMR important dans les formes sévères
Sur la base des données disponibles, la Commission de la Transparence a attribué à TREMFYA un service médicale rendu (SMR) important dans le traitement du psoriasis en plaques de l'adulte, chez les patients ayant un psoriasis en plaques chronique sévère, défini par :
- un échec (réponse insuffisante, contre-indication ou intolérance) à au moins deux traitements parmi les traitements systémiques non biologiques et la photothérapie ;
- et une forme étendue et/ou un retentissement psychosocial important.
Dans cette indication, la Commission considère que TREMFYA n'apporte pas d'amélioration du SMR (ASMR V) par rapport aux autres inhibiteurs d'interleukines, considérant notamment l'absence de démonstration méthodologiquement recevable d'une supériorité du guselkumab par rapport à l'ustékinumab (STELARA) et l'absence de comparaison directe avec le sécukinumab (COSENTYX), l'ixékizumab (TALTZ) et le brodalumab (KYNTHEUM).
Cependant, les anti-IL17 ayant démontré leur supériorité par rapport à l'ustékinumab chez des patients en échec aux traitements topiques n'étaient pas encore disponibles au moment de l'étude. Un essai randomisé en double aveugle comparant le guselkumab au sécukinumab (COSENTYX) chez des patients éligibles à un traitement systémique est actuellement en cours (étude ECLIPSE).
Dans la stratégie thérapeutique du psoriasis en plaques chronique, TREMFYA s'inscrit comme un traitement systémique de seconde intention, au regard de l'existence d'alternatives thérapeutiques en cas d'échec des traitements topiques et des incertitudes sur la tolérance à long terme du guselkumab.
A ce titre, la commercialisation de TREMFYA s'accompagne d'un plan de gestion des risques visant notamment à évaluer les risques potentiels d'infections graves, de cancer, de réactions allergiques (réactions d'hypersensibilité graves incluant le choc anaphylactique) et d'événements cardiovasculaires majeurs.
TREMFYA en pratique
TREMFYA est destiné à être utilisé sous la conduite et la surveillance d'un médecin expérimenté dans le diagnostic et le traitement du psoriasis en plaques.
Afin d'améliorer la traçabilité des produits biologiques, le nom et le numéro de lot du produit administré doivent être clairement consignés.
Avant d'initier le traitement par TREMFYA :
Afin d'améliorer la traçabilité des produits biologiques, le nom et le numéro de lot du produit administré doivent être clairement consignés.
Avant d'initier le traitement par TREMFYA :
- les patients doivent être examinés pour dépister une infection tuberculeuse (TB). Chez les patients recevant TREMFYA, les signes et symptômes d'une TB active doivent être surveillés pendant et après le traitement ;
- la réalisation de l'ensemble des vaccins appropriés devra être envisagée conformément aux recommandations vaccinales en vigueur.
Les vaccins vivants ne doivent pas être utilisés de façon concomitante à TREMFYA. Le traitement par TREMFYA doit être suspendu pendant au moins 12 semaines avant toute vaccination par un vaccin vivant viral ou bactérien et peut être repris au moins 2 semaines après la vaccination.
TREMFYA est administré par voie sous-cutanée.
La dose recommandée est de 100 mg (dose contenue dans une seringue préremplie) aux semaines 0 et 4, suivie d'une dose d'entretien toutes les 8 semaines.
En cas de survenue d'une réaction d'hypersensibilité grave, l'administration de TREMFYA doit être immédiatement interrompue et un traitement approprié doit être instauré.
L'arrêt du traitement doit par ailleurs être envisagé chez les patients ne présentant pas de réponse au bout de 16 semaines de traitement.
Sur avis du médecin et sous réserve d'une formation adéquate, l'auto-injection par le patient peut être envisagée.
Les sites d'injection sont le dessus des cuisses, le bas du ventre, voire l'arrière du haut des bras si l'injection est effectuée par un aidant.
L'injection ne doit pas être réalisée sur les sites présentant des lésions de psoriasis.
Conseils aux patients
La seringue préremplie de TREMFYA (Cf. Figure 4) est à usage unique.
Elle doit être conservée au réfrigérateur entre 2 et 8 °C, dans l'emballage extérieur et à l'abri de la lumière. Elle ne doit en aucun cas être agitée.
Avant l'utilisation de la seringue, celle-ci doit être sortie du réfrigérateur (à l'intérieur de la boîte) et laissée pendant 30 minutes à température ambiante. Aucune autre méthode ne doit être utilisée pour la réchauffer.
Figure 4 - Présentation de la seringue préremplie avant injection (extrait de la notice patient)
 |
Identité administrative
- Liste I
- Prescription initiale hospitalière annuelle
- Prescription réservée aux spécialistes et services en dermatologie et en médecine interne
- Boîte de 1 seringue préremplie, CIP 3400930122754
- Remboursable à 65 % selon la procédure des médicaments d'exception (prescription en conformité avec la Fiche d'information thérapeutique publiée au Journal officiel du 31 janvier 2019, texte 21)
Périmètre de remboursement de TREMFYA
Traitement du psoriasis en plaques de l'adulte, chez les patients ayant un psoriasis en plaques chronique sévère, défini par :
|
- Prix public TTC = 1 807,65 euros
- Agrément aux collectivités (Journal officiel du 31 janvier 2019, texte 22)
- Laboratoire Janssen-Cilag
Pour aller plus loin
Avis de la Commission de la Transparence - TREMFYA (HAS, 3 octobre 2018)
Pour aller plus loin
Consultez les monographies VIDAL
Sources
Pour recevoir gratuitement toute l’actualité par mail Je m'abonne !

 7 minutes
7 minutes Ajouter un commentaire
Ajouter un commentaire


Commentaires
Cliquez ici pour revenir à l'accueil.