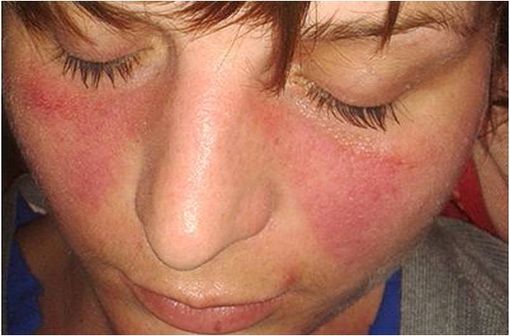
Erythème facial typique de lupus, en masque de loup (illustration @Doktorinternet, sur Wikimédia).
Nouvelle présentation en stylo prérempli pour administration SC
Une nouvelle présentation de l'anticorps monoclonal BENLYSTA (bélimumab) est mise à disposition, sous forme de stylo prérempli pour administration sous-cutanée (SC).
BENLYSTA SC 200 mg solution injectable en stylo prérempli s'ajoute à BENLYSTA 120 mg et 400 mg poudre pour solution à diluer pour perfusion IV (intraveineuse), déjà commercialisés en France depuis 2011.
A la différence de ces présentations IV distribuées uniquement à l'hôpital, BENLYSTA 200 mg SC est aussi disponible en ville, avec une prescription initiale hospitalière annuelle.
Son renouvellement est réservé aux spécialistes en médecine interne, rhumatologie, néphrologie ou dermatologie.
Même indication que la forme IV
BENLYSTA SC 200 mg, en association au traitement habituel, est indiqué chez les patients adultes atteints de lupus systémique actif avec présence d'auto-anticorps et activité de la maladie élevée (définie par exemple par la présence d'anticorps anti-ADN natif et un complément bas) malgré un traitement standard.
Cette indication est commune aux présentations IV de BENLYSTA.
 BENLYSTA SC fait l'objet d'une surveillance supplémentaire qui permettra l'identification rapide de nouvelles informations relatives à la sécurité. Les professionnels de santé déclarent tout effet indésirable suspecté.
BENLYSTA SC fait l'objet d'une surveillance supplémentaire qui permettra l'identification rapide de nouvelles informations relatives à la sécurité. Les professionnels de santé déclarent tout effet indésirable suspecté.BENLYSTA SC plus efficace que le placebo en termes de taux de répondeurs SRI
Dans son avis du 4 avril 2018, la Commission de la Transparence a évalué l'efficacité et la tolérance de BENLYSTA 200 mg par voie SC en stylo prérempli sur la base principalement d'une étude de phase III (étude BEL112341, Arthritis Rheumatol 2017 ; 69 : 1016-27), multicentrique, randomisée, en double aveugle, comparative versus placebo, d'une durée d'un an (52 semaines) dans laquelle les traitements étaient associés au traitement standard.
Le critère de jugement principal était un critère composite, le SRI (Systemic Lupus Erythematosus Responder Index) à la semaine 52 par rapport à l'inclusion. Le SRI définit comme répondeur un patient qui satisfait simultanément aux 3 conditions suivantes :
- réduction d'au moins 4 points du score SELENA-SLEDAI (un indice validé et pondéré pour évaluer l'activité du lupus systémique), et
- pas de nouvelle atteinte de système ou organe définie par :
- 1 BILAG (British Isles Lupus Assessment Group) A (correspond à des manifestations graves de la maladie nécessitant de fortes doses de corticoïdes, tels prednisone ou équivalent ? 20 mg/jour, et/ou des agents cytotoxiques)
- ou 2 BILAG B ( manifestations plus modérées de la maladie nécessitant des faibles doses de corticoïdes, des antipaludéens ou des anti-inflammatoires non stéroïdiens), et
- pas d'aggravation de l'état de santé global du patient selon le jugement du médecin (défini par une augmentation < 0,30 point sur l'échelle visuelle analogique PGA [Physician's Global Assessment]).
Selon les résultats de cette étude, après 52 semaines de traitement, le pourcentage de répondeurs SRI dans la population en ITT (n = 836) a été significativement plus important dans le groupe bélimumab que dans le groupe placebo (Cf. Tableau I).
Tableau I - Résultats de l'étude pivot BEL112341 sur le critère de jugement principal
| Population ITT à 52 semaines | Placebo N = 280 |
Bélimumab 200 mg S.C. N = 556 |
| SRI à la semaine 52 | ||
| Répondeurs SRI (%) | 48,4 | 61,4 |
| Différence | 12,98 | |
| OR (IC95 %) | 1,68 (1,25 ; 2,25) | |
| p | 0,0006 | |
En termes de tolérance, le profil de sécurité de bélimumab SC associé au traitement standard a été similaire à celui du traitement placebo associé au traitement standard.
Les effets indésirables les plus fréquemment rapportés (incidence supérieure d'au moins 1 % dans le groupe bélimumab que dans le groupe placebo), ont été des céphalées (9,3 % dans le groupe placebo et 10,3 % dans le groupe bélimumab), des infections bactériennes des voies urinaires (6,4 % dans le groupe placebo et 7,6 % dans le groupe bélimumab) et des arthralgies (3,9 % dans le groupe placebo et 5,8 % dans le groupe bélimumab).
En l'absence de donnée comparant directement les deux formulations de BENLYSTA (IV et SC), une comparaison indirecte entre la formulation déjà existante à la formulation sous-cutanée a été réalisée à titre indicatif. A l'issue de cette analyse exploratoire, les résultats observés étaient cohérents entre les deux formulations en termes d'efficacité et de tolérance, sans pouvoir conclure à l'équivalence ou à la non infériorité.
Le profil de tolérance de BENLYSTA SC 200 mg (1 injection/semaine) étant comparable à celui de la présentation déjà disponible IV (1 injection/mois), les risques attendus sont les mêmes pour les deux formulations et notamment les réactions d'hypersensibilité, les infections, l'immunisation, la leucoencéphalopathie multifocale progressive et les tumeurs malignes (y compris cancers de la peau non mélanome). Leur suivi et leur évaluation est poursuivi dans le cadre du plan de pharmacovigilance et des activités de réduction des risques.
SMR important, pas d'ASMR par rapport à la forme IV
Sur la base des données disponibles, la Commission de la Transparence considère que le service médical rendu (SMR) par BENLYSTA 200 mg solution injectable SC en stylo prérempli est important dans l'indication d'AMM (autorisation de mise sur le marché).
La Commission précise qu'en l'absence de données dans les atteintes rénales et neurologiques sévères, il n'est pas recommandé de prescrire le bélimumab dans ces formes de lupus.
Selon la Commission, la place de BENLYSTA SC est la même que celle de BELNLYSTA IV comme traitement de seconde intention, en association au traitement standard, dans le lupus systémique actif de l'adulte, avec présence d'auto-anticorps et activité de la maladie élevée après échec ou intolérance d'un traitement bien suivi par antimalariques de synthèse, AINS, corticoïdes et éventuellement immunosuppresseurs en fonction des atteintes viscérales spécifiques.
BENLYSTA 200 mg solution injectable SC en stylo prérempli étant un complément de gamme, il n'apporte pas d'amélioration du service médical rendu (ASMR V) par rapport à BENLYSTA 120 mg et 400 mg poudre pour solution à diluer pour perfusion IV.
Toutefois, la mise à disposition en ville de cette formulation SC de BENLYSTA et l'auto-injection possible par le patient à domicile, laisse envisager une simplification du traitement.
BENLYSTA SC en stylo prérempli en pratique
Le traitement par BENLYSTA doit être instauré et surveillé par un médecin expérimenté dans le diagnostic et le traitement du lupus systémique.
Les stylos préremplis de BENLYSTA SC sont à conserver au réfrigérateur, entre 2 et 8°C, dans l'emballage d'origine et à l'abri de la lumière. Avant l'injection, le stylo doit être ramené à température ambiante pendant 30 minutes.
BENLYSTA en stylo prérempli est administré par voie sous-cutanée, et permet de délivrer 200 mg de bévilumab par injection. La posologie recommandée est 200 mg 1 fois par semaine.
L'injection SC est réalisée dans l'abdomen ou la cuisse, en changeant de site d'injection chaque semaine.
- Premières injections sous surveillance
L'auto-injection de BENLYSTA SC peut être envisagée pour certains patients, sur avis du prescripteur. Les patients candidats à l'auto-injection doivent être préalablement formés à la technique de l'injection par voie sous-cutanée et recevoir les informations sur les signes et symptômes des réactions d'hypersensibilité (Cf. Encadré 1).
Encadré 1 - Symptômes de réactions d'hypersensibilité
et de réactions systémiques liées à l'injection
et de réactions systémiques liées à l'injection
| Symptômes de réactions d'hypersensibilité | Hypotension, angio-œdème, urticaire ou autre éruption cutanée, prurit et dyspnée |
| Symptômes de réactions systémiques liées à l'injection | Bradycardie, myalgie, maux de tête, éruption cutanée, urticaire, fièvre, hypotension, hypertension, vertiges et arthralgies |
- Description du stylo et injection
Le corps présent une fenêtre de visualisation, pour contrôler visuellement la solution injectable.
Pour l'injection, après avoir retiré le capuchon, le stylo doit être appliqué en faisant un angle de 90° avec la peau.
L'injection de BENLYSTA est déclenchée en pressant fermement le stylo sur la peau.
Un premier clic indique le début de l'injection.
Au niveau de la fenêtre de visualisation, un indicateur violet commence à apparaître.
Le stylo doit être maintenu jusqu'à ce que l'indicateur violet ait arrêté de bouger. Entre temps, un second clic s'est produit.
L'injection complète peut prendre jusqu'à 15 secondes.
- Durée de traitement
- De la voie IV à la voie SC
Identité administrative
- Liste I
- Prescription initiale hospitalière annuelle
- Prescription initiale et renouvellement réservés aux spécialistes en médecine interne, rhumatologie, néphrologie ou dermatologie
- Administration en milieu hospitalier pour les deux premières
- Boîte de 1 stylo, CIP 3400930126899, prix public TTC = 257,74 euros
- Boîte de 4 stylos, CIP 3400930126905, prix public TTC = 982,26 euros
- Remboursable à 65 % (Journal officiel du 7 août 2018 - texte 19)
- Agrément aux collectivités (Journal officiel du 7 août 2018 - texte 18)
- Laboratoire GlaxoSmithKline
Pour aller plus loin
Avis de la Commission de la Transparence - BENLYSTA SC 200 mg (HAS, 4 avril 2018)
Guide Maladie chronique - Lupus systémique (HAS, 2017)
Etude Pivot : Stohl W et al. Efficacy and Safety of Subcutaneous Belimumab in Systemic Lupus Erythematosus: A Fifty Two–Week Randomized, Double Blind, Placebo Controlled Study. Arthritis Rheumatol 2017 ; 69 : 1016-27
Pour aller plus loin
Consultez les monographies VIDAL
Consultez les VIDAL Recos
Sources
Pour recevoir gratuitement toute l’actualité par mail Je m'abonne !

 7 minutes
7 minutes Ajouter un commentaire
Ajouter un commentaire






Commentaires
Cliquez ici pour revenir à l'accueil.