Représentation en 3D de rétrovirus (illustration).
Première association fixe de 2 antirétroviraux
JULUCA 50 mg/25 mg comprimé pelliculé est indiqué dans le traitement de l'infection par le virus de l'immunodéficience humaine de type 1 (VIH-1), chez l'adulte virologiquement contrôlé (ARN du VIH-1 inférieur à 50 copies/mL) sous traitement antirétroviral stable depuis au moins 6 mois, sans antécédent d'échec virologique et sans résistance connue ou suspectée aux inhibiteurs non nucléosidiques de la transcriptase inverse ou aux inhibiteurs d'intégrase (Cf. VIDAL Reco "Infection par le VIH").
JULUCA correspond à une association fixe (la première) des 2 antirétroviraux suivants :
- un inhibiteur de l'intégrase (INI) : le dolutégravir (50 mg),
- un inhibiteur non nucléosidique de la transcriptase inverse (INNTI) : la rilpivirine (25 mg).
 JULUCA fait l'objet d'une surveillance supplémentaire qui permettra l'identification rapide de nouvelles informations relatives à la sécurité. Les professionnels de santé déclarent tout effet indésirable suspecté.
JULUCA fait l'objet d'une surveillance supplémentaire qui permettra l'identification rapide de nouvelles informations relatives à la sécurité. Les professionnels de santé déclarent tout effet indésirable suspecté.Efficacité démontrée dans la stratégie de désescalade
Dans son avis du 25 juillet 2018, la Commission de la Transparence a évalué JULUCA sur la base de deux études de phase III de non infériorité, ouvertes (SWORD 1 et SWORD 2), ayant évalué l'efficacité et la tolérance du changement d'une trithérapie conventionnelle (comprenant 2 INTI + 1 INNTI ou 1 INI ou 1 IP boosté ou non) à la bithérapie dolutégravir et rilpivirine (association libre TIVICAY + EDURANT, administrée une fois par jour) chez des patients virologiquement contrôlés par leur trithérapie en cours depuis au moins 6 mois et sans antécédent d'échec ou de résistance (n = 1 024).
Selon les résultats de ces études, l'efficacité de la bithérapie libre dans le cadre de cette stratégie de désescalade a été démontrée en termes de maintien du contrôle virologique (charge virale d'ARN VIH-1 inférieure à 50 copies/mL) à 48 semaines de traitement (critère de jugement principal) [Cf. Tableau I].
Tableau I - Etudes SWORD 1 et 2 - Proportion de patients ayant une charge virale d'ARN VIH-1 (CV) < 50 copies/mL à la semaine 48 (analyse statistique « snapshot ») (Population ITT-E et PP), d'après Avis de la Commission de la Transparence - JULUCA - 25 juillet 2018)
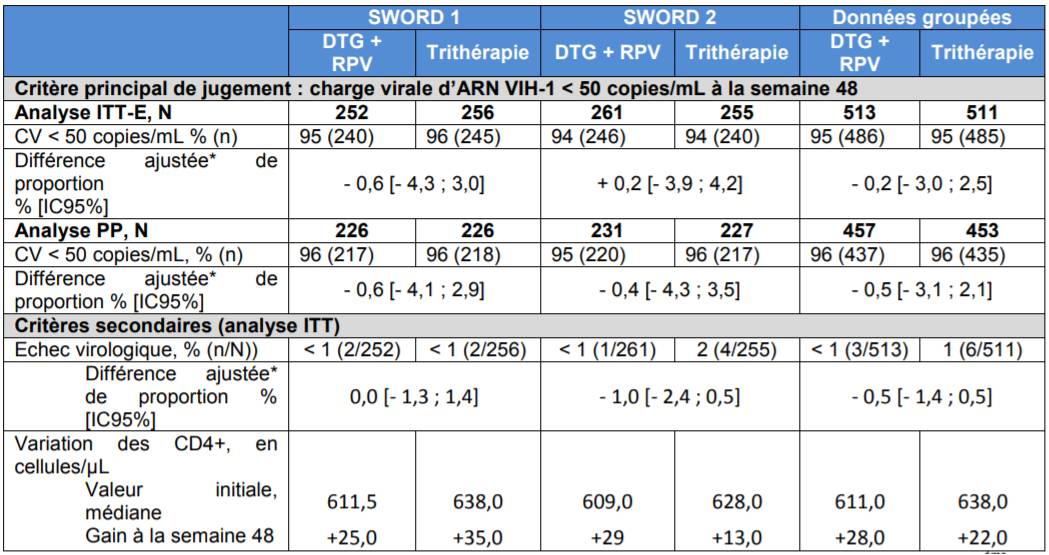
* basée sur l'analyse du test de Cochran-Mantel-Haenszel stratifiée sur l'âge (< ou = 50 ans) et sur la nature du 3e agent (IP, INNTI ou INTI)
Analyse selon l'approche Snapshot : correspond à la prise en compte de la dernière valeur de la charge virale observée entre les semaines 42 et 54 pour l'analyse à 48 semaines.
Cependant, la Commission fait remarquer que "la population sélectionnée limite la portée des résultats. En effet, les critères de non inclusion étaient multiples et comportaient notamment : femme enceinte ou allaitante ou qui prévoit de le devenir au cours de l'essai, insuffisance hépatique, co-infection VHB lors de la sélection ou nécessité d'un traitement anti-VHC au cours de l'essai et un risque suicidaire important".
Elle indique par ailleurs que la toxicité cumulée de chacune des substances composant JULUCA expose les patients à un risque important de survenue d'effets indésirables, en particulier d'ordre neuropsychiatrique.
Une autre étude de pharmacocinétique (étude 201676) a par ailleurs permis de démontrer la bioéquivalence de l'association fixe dolutégravir/rilpivirine (JULUCA) par rapport aux deux substances actives administrées individuellement (association libre).
Une simplification thérapeutique par rapport à la prise séparée des deux molécules
La Commission considère que JULUCA permet une simplification thérapeutique par rapport à la prise séparée des deux molécules (1 cp/j à la place de 2) lorsque la prescription de cette bithérapie est envisagée chez le patient virologiquement contrôlé et sans antécédent d'échec virologique ou de résistance.
Elle recommande une bonne observance du traitement en raison de la barrière génétique basse de la rilpivirine.
Sur la base du rapport Morlat 2017, la Commission situe JULUCA comme étant l'une des différentes stratégies d'optimisation thérapeutique recommandées chez les patients virologiquement contrôlés après une première ou deuxième ligne de trithérapie conventionnelle et sans antécédent d'échec, dans des circonstances spécifiques et avec des objectifs variables (maximiser l'efficacité, minimiser la toxicité, minimiser les interactions médicamenteuses ou minimiser l'émergence de résistances en cas d'échec, etc.).
Au total, le service médical rendu (SMR) de JULUCA est jugé important et l'amélioration du SMR absente (ASMR V) par rapport aux trithérapies conventionnelles et à l'association libre de ses deux composants.
JULUCA en pratique : 1 comprimé par jour, pendant les repas
JULUCA doit être prescrit par un médecin expérimenté dans la prise en charge de l'infection par le VIH.
La dose recommandée de 1 comprimé par jour, à prendre au cours d'un repas afin d'obtenir une absorption optimale de la rilpivirine.
Il est recommandé d'avaler le comprimé pelliculé en entier avec de l'eau, et de ne pas le mâcher ou l'écraser.
Le dolutégravir et la rilpivirine sont disponibles séparément dans les cas où l'arrêt, ou une adaptation posologique, de l'une des substances actives serait indiqué. Dans ces cas, le médecin doit se référer au résumé des caractéristiques du produit de ces médicaments (TIVICAY, EDURANT).
Dolutégravir et grossesse : risque d'anomalie de fermeture du tube neural
Des cas d'anomalies de fermeture du tube neural ont été rapportés dans une étude, chez des femmes recevant du dolutégravir au moment de la conception (notre article du 29 mai 2018).
Par mesure de précaution, il est recommandé :
- de ne pas prescrire de dolutégravir chez une femme envisageant une grossesse ;
- de rechercher systématiquement une grossesse avant d'initier un traitement par dolutégravir chez une femme en âge de procréer ;
- de prescrire une contraception chez les femmes en âge de procréer recevant du dolutégravir, pendant la durée de leur traitement ;
- de remplacer rapidement le dolutégravir par un autre antirétroviral chez toute femme traitée par dolutégravir au premier trimestre de la grossesse, dans la mesure des possibilités d'alternatives thérapeutiques appropriées pour la patiente.
Identité administrative
- Liste I
- Prescription initiale hospitalière annuelle
- Renouvellement non restreint
- Boîte de 30, CIP 3400930144824
- Remboursable à 100 % (Journal officiel du 26 octobre 2018, texte 15)
- Prix public TTC = 735,37 euros (Journal officiel du 26 octobre 2018, texte 16)
- Inscription sur liste de rétrocession (prise en charge à 100 %)
- Laboratoire ViiV Healthcare
Pour aller plus loin
Avis de la Commission de la Transparence - JULUCA (HAS, 25 juillet 2018)
Prise en charge médicale des personnes vivant avec le VIH. Recommandations du groupe d'expert sous la direction du Pr Philippe Morlat et sous l'égide du CNS et de l'ANRS (actualisation du 30 mai 2018)
Sur VIDAL.fr
VIH, dolutégravir et grossesse : risque potentiel d'anomalies de fermeture du tube neural (29 mai 2018)
Pour aller plus loin
Consultez les monographies VIDAL
Consultez les VIDAL Recos
Sources
Pour recevoir gratuitement toute l’actualité par mail Je m'abonne !

 5 minutes
5 minutes Ajouter un commentaire
Ajouter un commentaire.jpg)

.jpg)




Commentaires
Cliquez ici pour revenir à l'accueil.