L’adénocarcinome du pancréas est le plus souvent diagnostiqué à un stade avancé en raison d’une expression clinique tardive de la maladie (illustration).
Nouvel antinéoplasique hospitalier dans la prise en charge de l'adénocarcinome du pancréas métastatique
ONIVYDE 5 mg/mL solution à diluer pour perfusion est un nouvel antinéoplasique hospitalier dont le principe actif est de l'irinotécan encapsulé dans un nanoliposome (irinotécan chlorhydrate trihydrate liposomal pégylé, ou nal-irinotécan).
ONIVYDE est indiqué, en association avec le 5-fluorouracile (5-FU) et la leucovorine (LV), dans le traitement des adénocarcinomes du pancréas métastatiques, chez les patients adultes en progression de la maladie après un traitement ayant comporté de la gemcitabine.
Du fait de sa formulation liposomale, ONIVYDE n'est pas équivalent aux formulations d'irinotécan non liposomales ; ces formulations ne sont pas interchangeables.
Une survie globale augmentée de 1,9 mois en médiane par rapport au 5-FU/LV
Dans son avis du 19 avril 2017, la Commission de la transparence a évalué ONIVYDE (nal-irinotécan) principalement sur la base d'une étude de phase III (NAPOLI-1) randomisée en ouvert, ayant comparé le nal-irinotécan (nal-IRI), seul ou en association au 5-FU/LV, au 5FU-LV chez 417 patients atteints d'un adénocarcinome du pancréas métastatique, en progression après un traitement (néo)adjuvant ayant comporté de la gemcitabine.
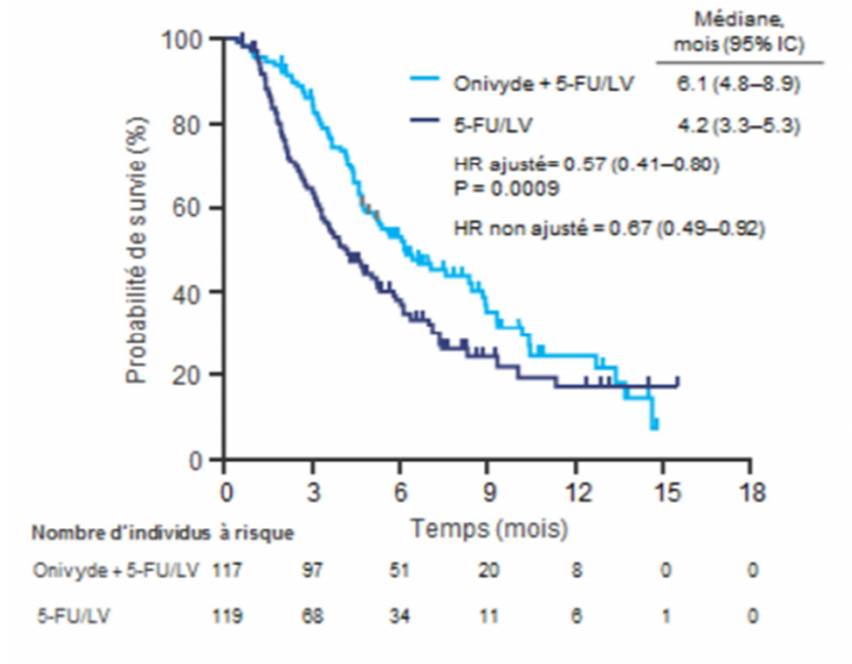
Selon les résultats de cette étude, la médiane de survie globale (délai entre la date de randomisation et la date de décès du patient toutes causes confondues : critère de jugement principal) a été plus longue dans le groupe nal-IRI/5-FU/LV (6,1 mois ; IC95% = [4,8 ; 8,9]) que dans le groupe le groupe 5-FU/LV (4,2 mois ; IC95 % = [3,3 ; 5,3]), soit un gain absolu de 1,9 mois en faveur de l'ajout du nal-IRI au protocole 5-FU/LV (HR non ajusté : 0,67 ; IC95% = [0,49 ; 0,92] ; p = 0,0122) [Cf. Figure 1].
 |
Toutefois, la Commission souligne plusieurs limites méthodologiques impactant la transposabilité de ces résultats, notamment les différences entre les doses et les schémas d'administration de 5-FU et de leucovorine limitant la comparaison des deux groupes :
- la perfusion plus longue de 5-FU et la dose plus élevée de leucovorine dans le groupe nal-IRI/5-FU/LV sont en faveur du groupe nal-IRI/5-FU/LV,
- la dose cumulée sur un cycle de 5-FU plus élevée dans le groupe 5-FU/LV (8000 mg/m²) que dans le groupe nal-IRI/5-FU/LV (7 200 mg/m²) est en faveur du groupe 5-FU/LV.
La supériorité de l'ajout du nal-IRI au protocole 5-FU/LV a également été démontrée sur les critères de jugement secondaires hiérarchisés :
- la médiane de survie sans progression (délai entre la date de randomisation et la date d'observation d'une progression de la maladie ou du décès du patient) évaluée par l'investigateur : 3,1 mois versus 1,5 mois, soit un gain absolu de 1,6 mois (HRnon ajusté : 0,56 ; IC95% = [0,41 ; 0,75] ; p = 0,0001) ;
- le pourcentage de réponse objective complète ou partielle sur avis de l'investigateur confirmé à 4 semaines : 7,8 % (n = 9) versus 0,84 % (n = 1) (RR : 6,85 ; IC95% = [1,75, 11,95]).
Un profil de tolérance moins favorable
Le gain d'efficacité obtenu par l'association du nal-IRI au 5FU/LV a été obtenu au prix d'une tolérance dégradée notamment en termes d'événements indésirables graves liés au traitement (23,1% versus 9,0%) et d'événements indésirables de grade 3 ou plus liés au traitement (53,8% versus 17,9%).
Des risques importants ont été identifiés : diarrhée, leucopénie/neutropénie, anémie, réaction aigüe à la perfusion et événement thromboembolique.
Un traitement de 2e ligne et plus chez les patients en bon état général
Sur la base des données disponibles lors de cette évaluation, la Commission de la transparence considère que la place d'ONIVYDE dans la stratégie thérapeutique est celle d'un traitement de 2e ligne et plus chez les patients en bon état général (score de performance de Karnofsky supérieur ou égal à 70 % et bilan hépatique normal) atteints d'un adénocarcinome du pancréas métastatique en progression après un traitement ayant comporté de la gemcitabine.
La Commission ajoute que, faute de données comparatives adéquates versus les protocoles de polychimiothérapie recommandés à ce stade de la maladie (FOLFOX : 5- FU/leucovorine/oxaliplatine ou FOLFIRI : 5- FU/leucovorine/irinotécan, notamment), la place d'ONIVYDE ne peut être précisée.
En l'absence de données versus le protocole FOLFIRINOX (5-FU/LV + irinotécan + oxaliplatine), l'utilisation d'ONIVYDE en 1re ligne métastatique n'est par ailleurs pas recommandée chez les patients en progression après un traitement par gemcitabine en (néo)adjuvant.
Au total, le service médical rendu (SMR) par ONIVYDE est jugé important et l'amélioration du SMR absente (ASMR V).
ONIVYDE en pratique
ONIVYDE est une solution injectable à diluer.
Après dilution avec une solution de glucose pour injection à 5 % ou une solution de chlorure de sodium pour injection à 9 mg/mL (0,9 %), ONIVYDE est administrée par perfusion intraveineuse de 90 minutes.
- Posologie recommandée et schéma d'administration
- 80 mg/m² d'ONIVYDE en perfusion intraveineuse de 90 minutes,
- suivis de 400 mg/m² de LV en perfusion intraveineuse de 30 minutes,
- suivis de 2 400 mg/m² de 5-FU en perfusion intraveineuse de 46 heures.
Des ajustements de doses doivent être envisagés :
- chez les patients homozygotes pour l'allèle UGT1A1*28 : diminution de la dose initiale d'ONIVYDE à 60 mg/m² (la HAS recommande la recherche systématique du polymorphisme UGT1A1*28 avant l'instauration du traitement) ;
- si ONIVYDE est bien toléré, augmentation de la dose à 80 mg/m² lors des cycles suivants ;
- en cas de toxicité de grade 3 ou 4 liée à ONIVYDE : diminution de la dose, voire interruption du traitement.
- Prémédication à base de sétron et corticoïde
Surveillance des patients
La surveillance des patients au cours du traitement par ONIVYDE porte sur :
- l'hémogramme, en raison d'un risque de myélosuppression et de neutropénie ;
- la fonction hépatique : bilirubine et transaminases ;
- les signes cliniques comme la fièvre : les patients doivent être informés sur ce point ;
- les signes d'infection ;
- les symptômes respiratoires.
Des facteurs de risque doivent également être pris en compte :
- le risque de neutropénie sévère et de neutropénie fébrile est accru chez les sujets ayant des antécédents de radiothérapie abdominale, ou les patients asiatiques.
Identité administrative
- Liste I
- Prescription hospitalière réservée aux spécialistes en oncologie ou aux médecins compétents en cancérologie
- Surveillance particulière pendant le traitement
- Flacon de 10 mL, CIP 3400930074152
- Agrément aux collectivités (Journal officiel du 20 juillet 2017 - texte 20)
- Laboratoire Shire France
Pour aller plus loin
Avis de la Commission de la transparence - ONIVYDE (HAS, 19 avril 2017)
Wang-Gillam A. Nanoliposomal irinotecan with fluorouracil and folinic acid in metastatic pancreatic cancer after previous gemcitabine-based therapy (NAPOLI-1) : a global, randomised, open-label, phase 3 trial. Lancet 2016; 387: 545-57

 6 minutes
6 minutes Ajouter un commentaire
Ajouter un commentaire


Commentaires
Cliquez ici pour revenir à l'accueil.