Dans les formes persistantes, en rechute ou métastatiques d’emblée du cancer du col de l'utérus, l’efficacité de la chimiothérapie demeure limitée avec une médiane de survie globale d’environ un an (illustration).
L'agrément aux collectivités de l'antinéoplasique hospitalier AVASTIN 25 mg/mL solution à diluer pour perfusion (bévacizumab) est étendu au traitement du cancer du col de l'utérus persistant, en rechute ou métastatique, en association au paclitaxel et au cisplatine, ou bien en association au paclitaxel et au topotécan chez les patientes ne pouvant pas recevoir de traitement à base de sels de platine.
Cette indication a été octroyée à AVASTIN en mars 2015.
Un gain modéré en survie globale et des réserves sur la robustesse des résultats
Dans son avis du 6 juillet 2016, la Commission de la transparence s'est appuyé sur l'étude d'efficacité et de tolérance de phase III GOG-0240 (Tewarik KS et coll. N Engl J Med 2014), ouverte, randomisée à 4 bras, en groupes parallèles (Cf. Figure 1), pour évaluer AVASTIN (bevacizumab) en association à une chimiothérapie en comparaison avec la même chimiothérapie seule, chez 452 patientes atteintes d'un carcinome du col de l'utérus, persistant, en rechute ou métastatique.
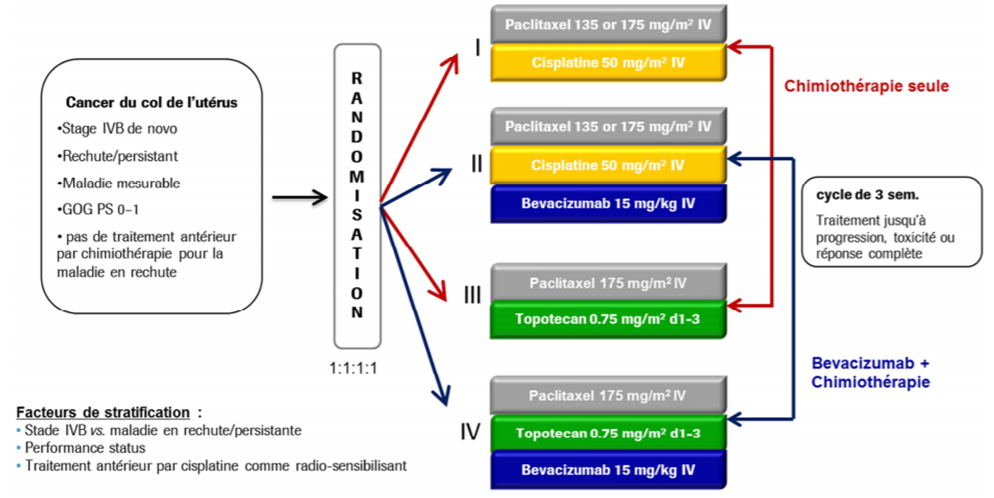
Les objectifs de cette étude étaient de déterminer :
- si une chimiothérapie sans sels de platine (topotécan-paclitaxel ± bevacizumab) permettait d'améliorer la survie globale par rapport à une chimiothérapie à base de sels de platine (cisplatine-paclitaxel ± bevacizumab) ;
- si l'ajout d'AVASTIN à une chimiothérapie (associations cisplatine-paclitaxel et topotécan-paclitaxel) permettait d'améliorer la survie globale par rapport à la chimiothérapie seule.
Selon les résultats de cette étude, la médiane de survie globale (critère de jugement principal) obtenue :
- avec la chimiothérapie sans sels de platine (topotécan-paclitaxel ± bevacizumab) n'a pas été différente de celle de la chimiothérapie avec sels de platine (cisplatine-paclitaxel ± bevacizumab) : 13,3 mois versus 15,5 mois respectivement ;
- dans le groupe AVASTIN + chimiothérapie, a été meilleure que celle du groupe chimiothérapie seule : 16,8 mois versus 12,9 mois respectivement, soit une différence de 3,9 mois en faveur d'AVASTIN. La Commission note cependant que "cette valeur (3,9 mois) est probablement surestimée du fait d'un arrêt prématuré de l'étude. Des réserves sont émises quant à la robustesses des résultats".
S'agissant de la médiane de survie sans progression (critère secondaire), elle a été de 8,3 mois dans le groupe AVASTIN + chimiothérapie versus 6,0 mois dans le groupe chimiothérapie seule (HR = 0,66, IC95% [0,54 ; 0,81], p < 0,0001), soit une différence de 2,3 mois en faveur du groupe AVASTIN + chimiothérapie.
Là encore, la portée de ce résultat est limitée selon la Commission qui fait remarquer qu'il n'y avait pas de relecture centralisée par un comité indépendant.
Une toxicité accrue, notamment des fistules rectovaginales
En termes de tolérance, les résultats de l'étude pivot indiquent :
- une fréquence des arrêts de traitement liés à des événements indésirables de 26,1% dans le groupe AVASTIN + chimiothérapie (allant jusqu'à 33% dans le sous-groupe AVASTIN + cisplatine- paclitaxel) versus 18 % dans le groupe chimiothérapie seule ;
- une fréquence des événements indésirables d'intérêt particulier (tous grades) plus élevée dans le groupe AVASTIN + chimiothérapie par rapport au groupe chimiothérapie seule avec notamment :
- une hypertension artérielle de grade supérieur ou égal 3 (respectivement, 11,5 % et 0,5 %),
- des perforations gastro-intestinales de tous grades (respectivement, 3,2 % et 0 %),
- des fistules gastro-intestinales/vaginales de tous grades (respectivement 8,3 % et 0,9 %), majoritairement recto-vaginales,
- des saignements de grade supérieur ou égal à 3 (respectivement 7,3 % et 4,5 %),
- des événements thromboemboliques veineux de grade supérieur ou égal à 3 (respectivement, 10,6 % et 6,3 %).
Au vu de ces résultats, la Commission souligne l'importance de prendre en considération le profil de tolérance d'AVASTIN avant de le prescrire et d'informer les patientes sur ces événements indésirables avant d'instaurer le traitement.
Un SMR important et une ASMR mineure
Considérant la gravité du cancer du col de l'utérus persistant, en rechute ou métastatique (taux de survie à 5 ans < 5 % et médiane de survie globale sous chimiothérapie d'environ 1 an), et le rapport efficacité/effets indésirables moyen du bévacizumab en raison de son profil de tolérance et notamment des fistules, en majorité rectovaginales, la Commission a attribué un SMR (service médical rendu) important à AVASTIN dans cette indication et considéré qu'il apportait une amélioration du SMR mineure (ASMR IV) en ajout à la chimiothérapie par paclitaxel et cisplatine (ou topotécan en cas d'inéligibilité aux sels de platine) par rapport à la chimiothérapie seule.
En pratique : posologie et conditions de prescription
Dans le traitement du cancer du col de l'utérus, AVASTIN est administré en association avec l'un des protocoles de chimiothérapie suivants :
- paclitaxel et cisplatine,
- ou paclitaxel et topotécan.
La dose recommandée est de 15 mg/kg de poids corporel administré 1 fois toutes les 3 semaines en perfusion intraveineuse.
Le traitement doit être poursuivi jusqu'à progression de la maladie sous-jacente ou la survenue d'une toxicité inacceptable.
Pour donner droit à sa prise en charge, AVASTIN doit être prescrit par un médecin spécialiste ou compétent en oncologie ou en cancérologie.
L'étude pivot
Krishnansu S. Tewari et coll. Improved Survival with Bevacizumab in Advanced Cervical Cancer. N Engl J Med 2014; 370:734-743
Pour aller plus loin
Arrêté du 26 décembre 2016 modifiant la liste des spécialités pharmaceutiques agréées à l'usage des collectivités et divers services publics (Journal officiel du 28 décembre 2016 - texte 45)
Arrêté du 26 décembre rectifié par l'arrêté du 28 décembre 2016 (Journal officiel du 30 décembre 2016 - texte 90)
Avis de la Commission de la transparence (HAS, 6 juillet 2016)
Sur VIDAL.fr
AVASTIN (bevacizumab) : deux extensions de prise en charge dans le cancer de l'ovaire (10 février 2016)

 5 minutes
5 minutes Ajouter un commentaire
Ajouter un commentaire


Commentaires
Cliquez ici pour revenir à l'accueil.