Myélome multiple : image histopathologique d'un extrait de la moelle osseuse. Coloration à l'hématoxyline et à l'éosine (illustration @Wikimedia).
FARYDAK (panobinostat) est le premier médicament d'une nouvelle classe d'anticancéreux appelés inhibiteurs de l'histone désacétylase (HDAC).
Il est indiqué, en association avec le bortézomib et la dexaméthasone, dans le traitement des patients adultes atteints de myélome multiple en rechute et/ou réfractaire ayant déjà reçu au moins deux lignes de traitement antérieur incluant du bortézomib et un agent immunomodulateur.
Présenté sous forme de gélule, FARYDAK est disponible sous 3 dosages : 10 mg, 15 mg et 20 mg.
Ont été octroyées à FARYDAK une autorisation temporaire d'utilisation (ATU) de cohorte début août par l'ANSM, puis une autorisation de mise sur le marché (AMM) européenne fin août 2015, sous le statut de médicament orphelin par la Commission européenne.
A propos du panobinostat
Le principe actif de FARYDAK est le panobinostat.
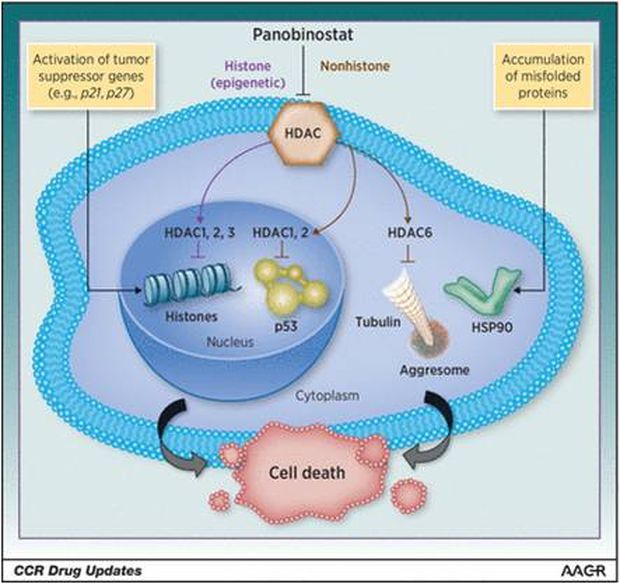
Il bloque l'activité de l'histone désacétylase (HDAC), enzyme impliquée dans l'activation et la désactivation des gènes dans les cellules.
L'inhibition de l'activité HDAC entraîne une augmentation de l'acétylation des histones, une altération épigénétique qui se traduit par une détente de la chromatine entraînant l'activation de la transcription (voir Figure 1).
In vitro, le panobinostat a provoqué l'accumulation des histones acétylées et d'autres protéines, induisant un arrêt du cycle cellulaire et/ou l'apoptose de quelques cellules transformées.
(d'après Jacob P. Laubach and al. Clin Cancer Res; 21(21); 4767–73)
Un bénéfice significatif en termes de survie sans progression, démontré versus placebo
La décision européenne d'autoriser FARYDAK dans le traitement du myélome multiple s'appuie sur une étude principale de phase III, PANORAMA 1, multicentrique, contrôlée versus placebo, en double aveugle, conduite chez des patients atteints de myélome multiple en rechute ou en rechute et refractaire (n = 768), ayant reçu 1 à 3 lignes de traitements antérieurs (The Lancet Oncology, 2014, abstract).
Les patients ont reçu du panobinostat (20 mg per os une fois par jour, trois fois par semaine, pendant 2 semaines suivies d'une semaine sans traitement) ou un placebo, associé au bortézomib (1,3 g/m² IV) et à la dexaméthasone (20 mg).
Le principal critère d'évaluation était la survie sans progression (SSP).
Les résultats préliminaires de cette étude, toujours en cours actuellement, ont montré :
- dans l'ensemble de la population de patients (1 à 3 lignes de traitements antérieurs, n = 768), une SSP médiane de 12 mois dans le bras panobinostat + bortézomib + dexaméthasone (n = 387, IC à 95 % : [10,3, 12,9]) et de 8,1 mois dans le bras placebo + bortézomib + dexaméthasone (n = 381, IC à 95 % : [7,6, 9,2]), p < 0,0001) ;
- dans le sous-groupe de patients prédéfini traités antérieurement par au moins deux lignes de traitement par bortézomib et un agent immunomodulateur (n = 147), une SSP médiane de 12,5 mois dans le bras panobinostat + bortézomib + dexaméthasone (IC 95 % : 7,26 ; 14,03) et de 4,7 mois dans le bras placebo + bortézomib + dexaméthasone (IC 95 % : 3,71 ; 6,05) [HR 0,47 (0,31 ; 0,72)]
Le bénéfice en termes de survie globale (principal critère secondaire) n'a en revanche pas été démontré, le nombre final d'événements de SG n'étant pas encore atteint au moments de la publication de ces résultats préliminaires.
Dans l'étude de phase II, PANORAMA 2 (Blood, 2013), multicentrique à un seul bras menée en ouvert chez 55 patients en rechute et réfractaires au bortézomib, ayant reçu au moins 2 lignes de traitements antérieurs, le taux de réponse globale après 8 cycles de traitement par le panobinostat (critère principal d'évaluation), en association au bortézomib et à la dexaméthasone, a été 34,5 % et le taux de réponse minimale de 52,7 %.
Le délai médian de réponse a été de 1,4 mois, la durée médiane de réponse de 6 mois et la survie globale médiane de 17,5 mois.
Tolérance de FARYDAK : la balance bénéfice/risque est positive
Les effets indésirables les plus couramment observés sous FARYDAK ont été de type diarrhée, nausée et vomissement, fatigue, ainsi que des troubles hématologiques (thrombocytopénie, anémie, neutropénie, lymphopénie).
Des effets indésirables d'ordre cardiaque ont également été observés (10 à 20 %) à type de troubles du rythme (tachycardie, fibrillation auriculaire, etc.) et, plus rarement, allongement de l'intervalle QTc.
Tenant compte de ces effets indésirables sérieux, le CHMP (comité des médicaments à usage humain) a approuvé l'utilisation de FARYDAK uniquement chez les patients en rechute et/ou réfractaires, après au moins 2 traitements antérieurs incluant le bortézomib et un agent immunomodulateur (thalidomide, lénalidomide ou pomalidomide).
La commercialisation de FARYDAK s'accompagne d'un plan de gestion des risques visant à surveiller la sécurité de ce médicament et comportant notamment du matériel d'information destiné aux professionnels de santé, du matériel éducatif destiné aux patients (dont une carte patient), ainsi que la fourniture par le laboratoire NOVARTIS PHARMA d'une analyse finale de la durée de survie des patients à partir de l'étude principale PANORAMA 1.
Les professionnels de santé déclarent tout effet indésirable suspecté.
FARYDAK en pratique
- Traitement initial : 20 mg par jour, 6 jours par cycle, pendant 8 cycles
Les gélules doivent être prises à la même heure chaque jour, avec ou sans aliments. Elles ne doivent pas être ouvertes, écrasées ou mâchées.
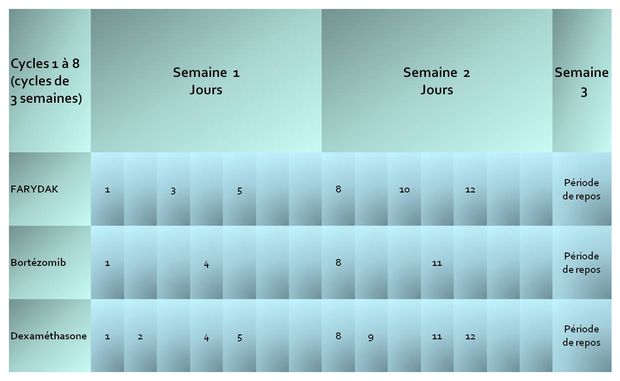
Le traitement initial comporte 8 cycles (voir Tableau 1).
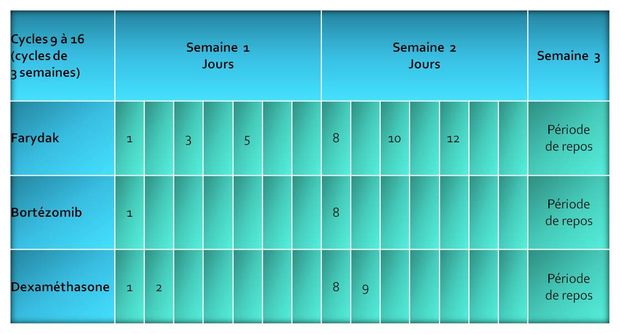
Chez les patients présentant un bénéfice clinique, le traitement peut être prolongé de 8 cycles avec un calendrier d'administration différent de celui des 8 premiers cycles, portant la durée totale de traitement à 16 cycles, soit 48 semaines (voir Tableau 2).
Concernant les traitements associés :
- la dose recommandée de bortézomib est de 1,3 mg/m² administrée par injection ;
- la dose recommandée de dexaméthasone est de 20 mg administrée par voie orale à estomac plein.
- Surveillance à toutes les étapes du traitement
- une numération de la formule sanguine complète (risque de thrombopénie, de neutropénie) ;
- un ECG (risque d'allongement du QTc) ;
- un dosage des électrolytes sanguins, en particulier le potassium, le magnésium et le phosphore ;
un contrôle de la fonction hépatique.
Ces éléments doivent être surveillés pendant le traitement, ainsi que le contrôle de la fonction thyroïdienne.
La surveillance des paramètres sanguins, en particulier avant chaque injection de bortézomib, vise notamment à détecter une thrombopénie.
- Adaptation posologique : par palier de 5 mg
Dans ce cas, la dose de panobinostat doit être réduite par paliers de 5 mg (c'est-à-dire de 20 mg à 15 mg ou de 15 mg à 10 mg), sans être inférieure à 10 mg.
Le calendrier de traitement (cycle de traitement de 3 semaines) doit être conservé.
- Prescrire une contraception féminine et masculine efficace
Les femmes utilisant des contraceptifs hormonaux doivent employer en plus une méthode contraceptive dite de barrière.
Les hommes doivent utiliser des préservatifs au cours du traitement et pendant 6 mois après l'arrêt du traitement.
- Conseils aux patients
En cas de vomissements, le patient ne doit pas prendre de dose supplémentaire, mais prendre la dose suivante prescrite à l'heure habituelle.
La consommation de carambole, de pamplemousse et de jus de pamplemousse, de grenade et de jus de grenade est à éviter en raison d'un risque d'interaction. Ces boissons peuvent augmenter la biodisponibilité du panobinostat.
Identité administrative
- Liste I
- Prescription hospitalière réservée aux spécialistes en oncologie ou en hématologie, ou aux médecins compétents en cancérologie ou en maladies du sang
- Surveillance particulière pendant le traitement
- FARYDAK 10 mg, boîte de 6 gélules, CIP 3400930024669
- FARYDAK 15 mg, boîte de 6 gélules, CIP 3400930024683
- FARYDAK 20 mg, boîte de 6 gélules, CIP 3400930024690
- Pris en charge par les collectivités et rétrocédable par prolongation des conditions d'inscription au titre de l'ATU de cohorte, selon les conditions définies à l'article L.162-16-5-2 du code de la Sécurité sociale (demande de remboursement et d'agrément aux collectivités à l'étude)
- Laboratoire Novartis Pharma SAS
Pour aller plus loin
Se reporter à la monographie VIDAL de FARYDAK
First HDAC inhibitor for treatment of multiple myeloma recommended for approval in EU (EMA, 26 juin 2015)
Résumé EPAR pour le public (EMA, actualisé le 11 septembre 2015)
Références
Richardson PG and al. PANORAMA 2 : panobinostat in combination with bortezomib and dexamethasone in patients with relapsed and bortezomib-refractory myeloma. Blood 2013 ; 122(14) : 2331-7 (abstract)
Jesús F San-Miguel and al. Panobinostat plus bortezomib and dexamethasone versus placebo plus bortezomib and dexamethasone in patients with relapsed or relapsed and refractory multiple myeloma: a multicentre, randomised, double-blind phase 3 trial. The Lancet Oncology 2014 ; 11(15) : 1195–1206 (texte complet)

 8 minutes
8 minutes Ajouter un commentaire
Ajouter un commentaire


Commentaires
Cliquez ici pour revenir à l'accueil.