Helicobacter pylori (illustration)
Deux précédents candidats vaccins ont échoué à éradiquer HP, mais ont suscité une réponse immunitaire encourageante
En 2001, Kotloff KL et coll. n'avaient pas réussi à obtenir une éradication d'Helicobacter pylori (HP) chez des adultes, infectés ou non, dans un essai de phase I avec un vaccin cellulaire inactivé. Ce vaccin avait tout de même déclenché une réponse immune chez les sujets non infectés, suscitant l'espoir de mettre au point un vaccin efficace.
Un autre vaccin comportant des fractions de l'uréase et de l'entérotoxine thermosensible d'Helicobacter pylori a été testé, versus entérotoxine seule ou placebo chez 26 volontaires infectés (double aveugle). Ces deux versions d'un candidat vaccin n'ont pas permis d'éradication mais celui associant l'uréase et l'entérotoxine thermosensible d'HP ont suscité une réponse immunitaire significative.
D'une manière générale, les vaccins tentés depuis 2000 n'ont pas d'efficacité thérapeutique probante chez les adultes infectés.
Un candidat vaccin chinois à base d'uréase et d'entérotoxine thermosensible d'HP
Ming Zeng (Jiangsu, Chine) et ses collaborateurs, après analyse de la littérature (très brièvement résumée ci-dessus), ont opté pour une formulation par fusion protéique de la sous-unité B de l'uréase et de la sous-unité B de l'enterotoxine thermosensible de l'HP, formulation développée par la société Kangwei Biological Technology (Nankin).
Devant le constat d'une meilleure réponse immunitaire chez les sujets non infectés lors d'études précliniques, ils ont fait le choix, pour leur essai clinique de phase III publié dans The Lancet, de tester leur vaccin sur 5 785 élèves de 6 à 15 ans des écoles de la province de Jiangsu, a priori non encore exposés à la bactérie.
Néanmoins, environ 20 % de leur échantillon d'enfants de 6 à 15 ans testés (sérologie ELISA ou test respiratoire à l'urée) étaient déjà infectés par H. pylori.
Plus de 4 000 enfants ont reçu le candidat vaccin ou un placebo (double aveugle)
L'essai a donc inclus les 4 464 enfants de 6 à 15 ans non infectés, tous en bonne santé, recrutés entre 2004 et 2005. La randomisation s'est faite en double insu et le suivi, initialement prévu sur 1 an, a été prolongé pour atteindre 3 ans.
Le protocole d'administration consistait en l'administration de 3 doses orales (candidat vaccin ou placebo) à J0, J14 et J28 après 2 heures de jeûne.
L'équipe de recherche a revu chaque élève à M4, 8 et 12, et pratiqué à chaque fois des tests respiratoires à l'urée (ingestion d'urée marquée au carbone 13, recherche de CO2 marqué dans l'air expiré, signant un métabolisme de l'urée marquée par l'HP) : les résultats positifs ont été validés par des tests sanguins ELISA et confirmés par deux tests séparés.
La prolongation de l'étude pendant deux années supplémentaires a permis d'obtenir des données à M24 et 36, mais au prix d'une perte de puissance de l'étude par la perte de vue d'élèves ayant quitté leur établissement scolaire (les plus âgés à l'inclusion).
En tout, 2 199 enfants vaccinés et 2 204 enfants sous placebo ont cependant complété le protocole et le suivi. Un sous-groupe de 869 élèves a été formé pour étudier, versus placebo, l'immunogénicité du candidat vaccin.
Une bonne efficacité vaccinale à un an
Le pourcentage de survenue d'une primo-infection à HP dans les 12 mois suivant la vaccination (ou l'administration du placebo) constituait le critère principal d'efficacité (critère secondaire : pourcentage à 3 ans).
Un an après la première administration (vaccin ou placebo), 64 infections à HP ont été objectivées, significativement moins dans le groupe vacciné (14) que dans le groupe placebo (50, p < 0,0001).
Les auteurs estiment que cela correspond à une efficacité vaccinale non ajustée de 71,8 % (IC 95 : 48,2 à 85,6 %).
Une efficacité en baisse à 3 ans, mais toujours satisfaisante, bien que probablement surestimée
A 3 ans (M36), les auteurs ont relevé 16 infections supplémentaires dans le groupe vacciné, contre 35 supplémentaires dans le groupe placebo (p < 0,0001), correspondant à une efficacité vaccinale non ajustée de 55,8 % (IC95 : - 24,7 à 86,2 %) :
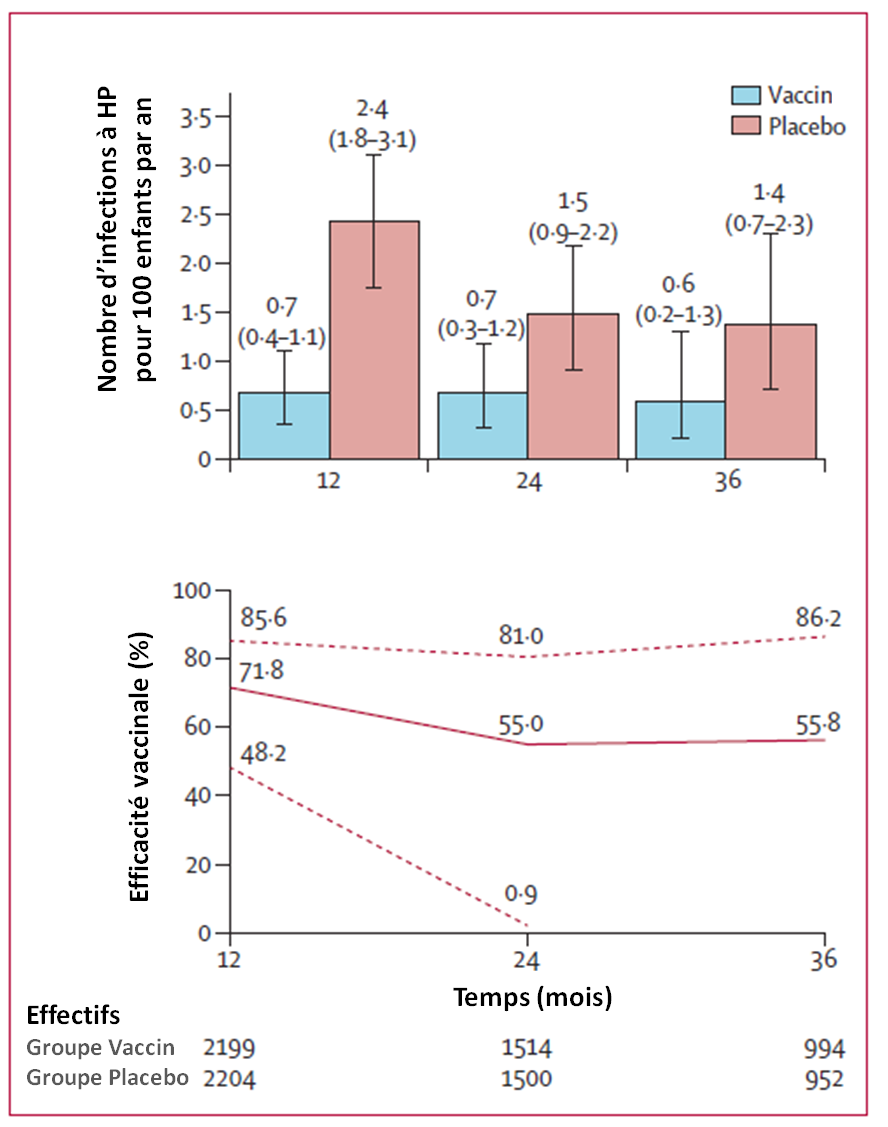
Mais, insistent les auteurs, les perdus de vue (élèves les plus âgés) ont "valorisé" les résultats obtenus chez les plus jeunes qui étaient déjà les plus réactifs à un an. En conséquence, l'efficacité à 3 ans est probablement surestimée.
Une immunogénicité convaincante, mais peut-être aussi surestimée
L'immunogénicité a été considérée consistante ("séroconversion") lorsque les anticorps anti-HP (IgG dans le sang et IgA dans la salive) ont été multipliés par 4 par rapport aux IgG et A constatés avant l'administration du vaccin ou du placebo.
Les résultats montrent que cela a été le cas jusqu'à M36 :
- Un mois après la troisième dose, la séroconversion du groupe vacciné (IgG sanguins) a atteint 86,1% (IC95 : 82,5 à 89.2 %), contre 4,6 % (2,8–7,0) dans le groupe placebo. Des résultats comparables ont été retrouvés avec les IgA (74,1 % dans le groupe vacciné) ;
- A 6 et 12 mois, cette séroconversion s'est maintenue au-dessus du seuil requis (multiplication au moins par 4) ;
- A 24 et 36 mois, le taux d'anticorps retrouvé était juste en-dessous du seuil requis, suggérant la nécessité d'une dose de rappel.
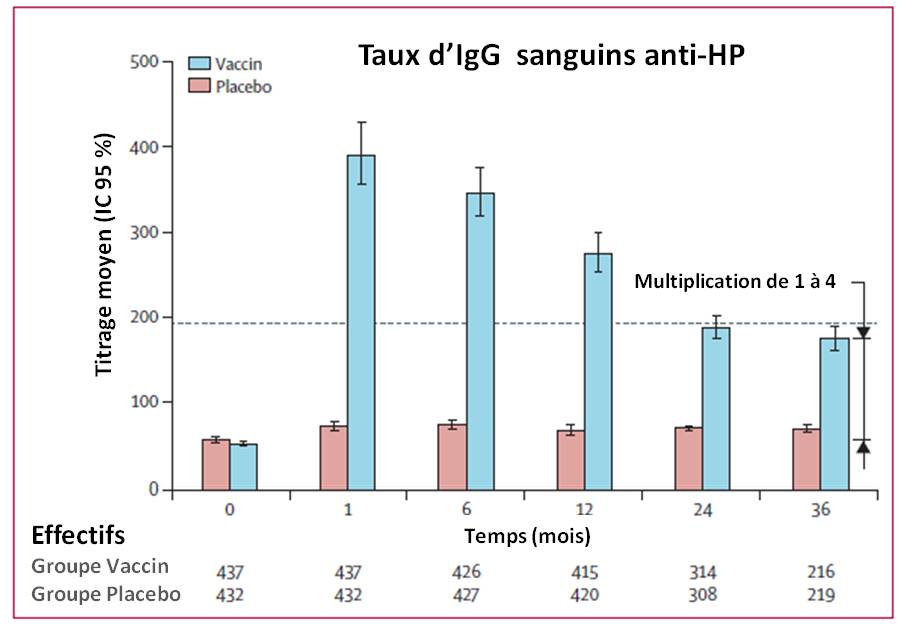
Les auteurs notent qu'il n'est pas exclu qu'il y ait eu contamination par HP au cours de l'étude. Du coup, l'estimation de l'efficacité vaccinale sur la production d'anticorps est peut-être, là aussi, surestimée.
Pas d'effets indésirables sérieux imputables au vaccin
157 enfants vaccinés se sont plaints d'effets indésirables dans le groupe du candidat vaccin, contre 161 enfants sous placebo, dans les 3 jours suivants l'absorption des doses vaccinales. Ces effets indésirables étaient mineurs (fièvre, maux de tête, vomissements) et spontanément résolutifs.
Seuls 5 enfants vaccinés et 7 sous placebo ont présenté des problèmes de santé sévères durant la première année de suivi, mais aucun n'est apparu lié à la vaccination.
Toutefois, soulignent les auteurs, le nombre d'enfants enrôlés est sans doute insuffisant pour affirmer, à ce stade, l'innocuité de cette vaccination.
En conclusion
L'infection à HP est très fréquente et à l'origine, chez une partie des personnes infectées, de pathologies gastriques pouvant être graves.
Le candidat vaccin chinois élaboré et testé par Ming Zeng et coll. sur plusieurs milliers d'enfants naïfs d'HP et versus placebo montre des résultats encourageants : efficacité vaccinale pour 7 enfants sur 10 à 1 an (et plus d'un enfant sur 2 à 3 ans), séroconversion satisfaisante pour près de 9 enfants vaccinés sur 10, tolérance a priori rassurante.
Un suivi plus prolongé de ces enfants et de nouvelles recherches devront cependant confirmer ces premiers résultats et montrer une diminution des pathologies gastriques, en particulier cancéreuses, avant d'envisager une éventuelle commercialisation de ce vaccin.
En savoir plus :
L'étude objet de cet article
Efficacy, safety, and immunogenicity of an oral recombinant Helicobacter pylori vaccine in children in China: a randomised, double-blind, placebo-controlled, phase 3 trial, Zeng M et coll., The Lancet , 1er juillet 2015.
Etudes citées sur les 2 précédents candidats vaccins
Safety and Immunogenicity of Oral Inactivated Whole-Cell Helicobacter pylori Vaccine with Adjuvant among Volunteers with or without Subclinical Infection, Kotloff KL et coll., Infection and Immunity, juin 2001
Oral immunization with urease and Escherichia coli heat-labile enterotoxin is safe and immunogenic in Helicobacter pylori-infected adults, Michetti P et coll., Gastroenterology, avril 1999
Barry J. Marshall et J. Robin Warren sur le site de la Fondation Nobel :
The Nobel Prize in Physiology or Medicine 2005
Présentation des conséquences de leurs découverte
Sources
Pour recevoir gratuitement toute l’actualité par mail Je m'abonne !

 6 minutes
6 minutes Ajouter un commentaire
Ajouter un commentaire






Commentaires
Cliquez ici pour revenir à l'accueil.