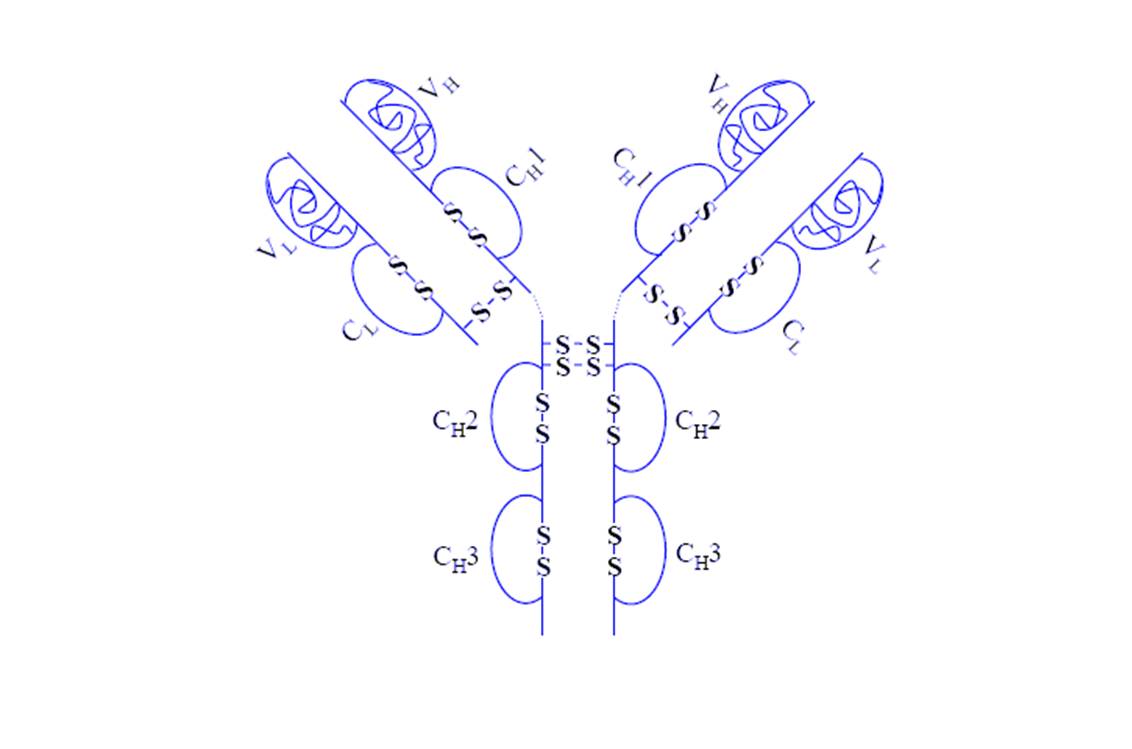
Structure de l’adalimumab (@ Monopol, Wikimedia)
Chez les patients adultes
Chez les enfants et les adolescents
La prise en charge d'HUMIRA 40 mg/0,8 ml solution injectable SC en flacon pour usage pédiatrique est étendue :
La prise en charge d'HUMIRA 40 mg solution injectable SC en seringue préremplie et en stylo prérempli est étendue au traitement de la maladie de Crohn active, modérée, chez les patients adultes qui n'ont pas répondu malgré un traitement approprié et bien conduit par un corticoïde et/ou un immunosuppresseur ou chez lesquels ce traitement est contre-indiqué ou mal toléré.
Chez les enfants et les adolescents
La prise en charge d'HUMIRA 40 mg/0,8 ml solution injectable SC en flacon pour usage pédiatrique est étendue :
- Au traitement de l'arthrite juvénile idiopathique polyarticulaire évolutive en association au méthotrexate chez l'enfant et l'adolescent de 2 à 17 ans en cas de réponse insuffisante à un ou plusieurs traitements de fond.
HUMIRA peut être administré en monothérapie en cas d'intolérance au méthotrexate ou lorsque la poursuite du traitement par le méthotrexate est inadaptée. HUMIRA n'a pas été étudié chez l'enfant de moins de 2 ans.
- Au traitement de la maladie de Crohn active, sévère, chez les enfants et les adolescents âgés de 6 à 17 ans, qui n'ont pas répondu à un traitement conventionnel comprenant un corticoïde, un immunomodulateur et un traitement nutritionnel de première intention, ou chez lesquels ces traitements sont mal tolérés ou contre-indiqués.
Pour mémoire
Le principe actif d'HUMIRA, l'adalimumab, est un immunosuppresseur sélectif, inhibiteur du TNF alpha.
La prescription initiale d'HUMIRA est hospitalière et annuelle.
La prescription initiale d'HUMIRA est hospitalière et annuelle.
La prescription d'HUMIRA 40 mg solution injectable SC en seringue préremplie et stylo préremplie est réservée aux spécialistes en rhumatologie, en gastro-entérologie, en chirurgie digestive, en dermatologie, en pédiatrie ou en médecine interne.
La prescription d'HUMIRA 40 mg/0,8 ml solution injectable SC en flacon pour usage pédiatrique est réservée aux spécialistes en rhumatologie, en gastro-entérologie, en chirurgie digestive, en pédiatrie ou en médecine interne.
Le taux de prise en charge est de 65 %.
Fiche d'information thérapeutique (Journal officiel du 18 février 2014)
Avis de la Commission de la transparence (HAS, 18 septembre 2013)
Synthèse d'avis de la Commission de la transparence (HAS, septembre-octobre 2013)
Arrêté du 11 février 2014 (texte 11), publié au Journal officiel du 18 février 2014
Avis de la Commission de la transparence (HAS, 18 septembre 2013)
Synthèse d'avis de la Commission de la transparence (HAS, septembre-octobre 2013)
Arrêté du 11 février 2014 (texte 11), publié au Journal officiel du 18 février 2014
Sources
Pour recevoir gratuitement toute l’actualité par mail Je m'abonne !

 2 minutes
2 minutes Ajouter un commentaire
Ajouter un commentaire


Commentaires
Cliquez ici pour revenir à l'accueil.