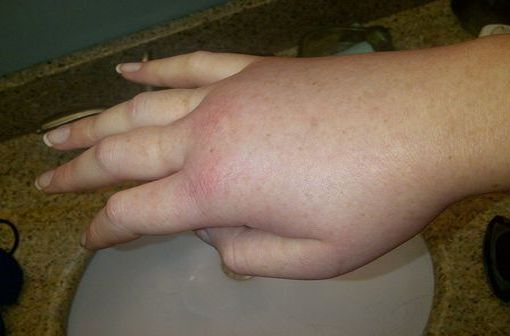
Le lanadélumab est un anticorps monoclonal entièrement humain (IgG1/κ-light chain, chaîne légère kappa). Il inhibe l'activité protéolytique de la kallikréine plasmatique active. L'augmentation de l'activité de la kallikréine plasmatique provoque des crises d'angio-œdème chez les patients atteints d'AOH par protéolyse du kininogène de haut poids moléculaire (KHPM) pour générer les KHPM clivés (KHPMc) et la bradykinine. Le lanadélumab permet un contrôle soutenu de l'activité de la kallikréine plasmatique, ce qui limite la génération de bradykinine chez les patients atteints d'AOH.
Les fiches DCI Vidal constituent une base de connaissances pharmacologiques et thérapeutiques, proposée aux professionnels de santé, en complément des documents réglementaires publiés.
Lanadélumab 300 mg/2 ml (150 mg/ml) solution injectable
Dernière modification : 08/01/2024 - Révision : 08/01/2024
| ATC | Risque sur la grossesse et l'allaitement | Dopant | Vigilance | ||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
B - SANG ET ORGANES HEMATOPOIETIQUES B06 - AUTRES MEDICAMENTS UTILISES EN HEMATOLOGIE B06A - AUTRES MEDICAMENTS UTILISES EN HEMATOLOGIE B06AC - MEDICAMENTS INDIQUES DANS L'ANGIO-OEDEME HEREDITAIRE B06AC05 - LANADELUMAB |
| ||||||||||||||||||||||||||||||||||||||||||||
INDICATIONS ET MODALITÉS D'ADMINISTRATIONLANADELUMAB 300 mg/2 ml sol injIndications
Ce médicament est indiqué dans les cas suivants :
- Oedème angioneurotique héréditaire, traitement de fond (de l')
PosologieUnité de priseml- lanadélumab : 150 mg
Modalités d'administration- Voie sous-cutanée
- Administrer dans le haut du bras, dans l'abdomen ou dans la cuisse
- Administrer en variant le site d'injection
- En cas d'oubli : prendre le traitement dès que possible
- Ne pas agiter le flacon
Posologie Patient de 2 an(s) à 12 an(s) 10 kg Oedème angioneurotique héréditaire, traitement de fond (de l') Posologie standard - En cas d'oubli : respecter un intervalle d'au moins 24 jours avec la dose suivante
- 150 mg 1 fois ce jour toutes les 4 semaines
Dans le cas de : Réponse insuffisante au traitement - En cas d'oubli : respecter un intervalle d'au moins 17 jours avec la dose suivante
- 150 mg 1 fois ce jour toutes les 3 semaines
20 kg Oedème angioneurotique héréditaire, traitement de fond (de l') Posologie standard - En cas d'oubli : respecter un intervalle d'au moins 10 jours avec la dose suivante
- 150 mg 1 fois ce jour toutes les 2 semaines
Dans le cas de : Etat stable - En cas d'oubli : respecter un intervalle d'au moins 24 jours avec la dose suivante
- 150 mg 1 fois ce jour toutes les 4 semaines
Poids >= 40 kg Oedème angioneurotique héréditaire, traitement de fond (de l') Posologie standard - En cas d'oubli : respecter un intervalle d'au moins 10 jours avec la dose suivante
- 300 mg 1 fois ce jour toutes les 2 semaines
Dans le cas de : Etat stable - En cas d'oubli : respecter un intervalle d'au moins 24 jours avec la dose suivante
- 300 mg 1 fois ce jour toutes les 4 semaines
Patient à partir de 12 an(s) Patient quel que soit le poids Oedème angioneurotique héréditaire, traitement de fond (de l') Posologie standard - En cas d'oubli : respecter un intervalle d'au moins 10 jours avec la dose suivante
- 300 mg 1 fois ce jour toutes les 2 semaines
Traitement ultérieur éventuel Dans le cas de : Etat stable - En cas d'oubli : respecter un intervalle d'au moins 24 jours avec la dose suivante
- 300 mg 1 fois ce jour toutes les 4 semaines
Modalités d'administration du traitement- Administrer dans le haut du bras, dans l'abdomen ou dans la cuisse
- Administrer en variant le site d'injection
- Administrer par voie sous-cutanée
- En cas d'oubli : prendre le traitement dès que possible
- Ne pas agiter le flacon
- Produit à usage unique, ne pas réutiliser
- Réservé à l'adulte et à l'enfant de plus de 2 ans
INFORMATIONS RELATIVES À LA SÉCURITÉ DU PATIENTLANADELUMAB 300 mg/2 ml sol injNiveau de risque : X Critique III Haut II Modéré I Bas
Contre-indicationsX Critique Niveau de gravité : Contre-indication absolue - Hypersensibilité à l'un des composants
- Hypersensibilité aux protéines de hamster
PrécautionsII Modéré Niveau de gravité : Précautions- Allaitement
- Grossesse
- Oedème angioneurotique héréditaire avec une activité normale de C1Inh
- Sujet de moins de 40 kg
Interactions médicamenteusesSe référer au paragraphe Interactions médicamenteuses de la documentation officielle du produit
Grossesse et allaitement
Contre-indications et précautions d'emploi Grossesse (mois) Allaitement 1 2 3 4 5 6 7 8 9 Risques II II II Précaution
Risques liés au traitement- Risque d'interférence avec les examens de laboratoire
- Risque de réaction d'hypersensibilité
Mesures à associer au traitement- N'est pas indiqué dans le traitement des crises aiguës d'oedème angioneurotique héréditaire
- Traçabilité recommandée
Traitement à arrêter définitivement en cas de...- Traitement à arrêter en cas d'apparition de réaction sévère d'hypersensibilité
Information des professionnels de santé et des patients- Info prof de santé : former le patient ou les proches à la technique de l'auto-injection
Effets indésirables
Systèmes Fréquence de moyenne à élevée (?1/1 000) Fréquence basse ( Fréquence inconnue ANOMALIE DES EXAMENS DE LABORATOIRE ALAT (augmentation) (Fréquent)
ASAT (augmentation) (Fréquent)
Anticorps (production)
DERMATOLOGIE Eruption maculopapuleuse (Fréquent)
Prurit
DIVERS Gêne
IMMUNO-ALLERGOLOGIE Hypersensibilité (Fréquent)
INSTRUMENTATION Réaction au point d'injection (Très fréquent)
Hémorragie au point d'injection
Sensation de chaleur au point d'injection
Paresthésie au point d'injection
Eruption cutanée au point d'injection
Ecchymose au point d'injection
Induration au site d'injection
Oedème au point d'injection
Gonflement au site d'injection
Erythème au point d'injection
Gêne au point d'injection
Prurit au point d'injection
Douleur au point d'injection
Hématome au site d'injection
ORL, STOMATOLOGIE Sensation de vertige (Fréquent)
SYSTÈME DIGESTIF Picotement de la langue
SYSTÈME MUSCULO-SQUELETTIQUE Douleur musculaire (Fréquent)
lanadélumab
Chimie
IUPAC immunoglobuline G1-kappa, anti-[Homo sapiens KLKB1
(kallikréine B 1, prékallikréine plasmatique (zymogène),
kininogénine, facteur de Fletcher) clivé protéolytiquement
par F12 (facteur FXII), kallikréine plasmatique active (EC
3.4.21.34)], Homo sapiens anticorps monoclonal;
chaîne lourde gamma1 (1-451) [Homo sapiens VH
(IGHV3-23*03 (91.80%) -(IGHD) -IGHJ3*02) [8.8.15] (1-
122) -IGHG1*03, G1m3 (CH1 (123-220), charnière (221-
235), CH2 (236-345), CH3 (346-450), CHS K2>del (451))
(123-451)], (225-213')-disulfure avec la chaîne légère
kappa (1'-213') [Homo sapiens V-KAPPA (IGKV1-5*03
(97.90%) -IGKJ1*01) [6.3.8] (1'-106') -IGKC*01, Km3 (107'-
213')]; dimère (231-231'':234-234'')-bisdisulfure Synonymes lanadelumab
Posologie
Defined Daily Dose (WHO) Parenteral : 21.4 mg
Indications
Ce médicament est indiqué dans les cas suivants :
- Oedème angioneurotique héréditaire, traitement de fond (de l')
PosologieUnité de priseml- lanadélumab : 150 mg
Modalités d'administration- Voie sous-cutanée
- Administrer dans le haut du bras, dans l'abdomen ou dans la cuisse
- Administrer en variant le site d'injection
- En cas d'oubli : prendre le traitement dès que possible
- Ne pas agiter le flacon
Posologie Patient de 2 an(s) à 12 an(s) 10 kg Oedème angioneurotique héréditaire, traitement de fond (de l') Posologie standard - En cas d'oubli : respecter un intervalle d'au moins 24 jours avec la dose suivante
- 150 mg 1 fois ce jour toutes les 4 semaines
Dans le cas de : Réponse insuffisante au traitement - En cas d'oubli : respecter un intervalle d'au moins 17 jours avec la dose suivante
- 150 mg 1 fois ce jour toutes les 3 semaines
20 kg Oedème angioneurotique héréditaire, traitement de fond (de l') Posologie standard - En cas d'oubli : respecter un intervalle d'au moins 10 jours avec la dose suivante
- 150 mg 1 fois ce jour toutes les 2 semaines
Dans le cas de : Etat stable - En cas d'oubli : respecter un intervalle d'au moins 24 jours avec la dose suivante
- 150 mg 1 fois ce jour toutes les 4 semaines
Poids >= 40 kg Oedème angioneurotique héréditaire, traitement de fond (de l') Posologie standard - En cas d'oubli : respecter un intervalle d'au moins 10 jours avec la dose suivante
- 300 mg 1 fois ce jour toutes les 2 semaines
Dans le cas de : Etat stable - En cas d'oubli : respecter un intervalle d'au moins 24 jours avec la dose suivante
- 300 mg 1 fois ce jour toutes les 4 semaines
Patient à partir de 12 an(s) Patient quel que soit le poids Oedème angioneurotique héréditaire, traitement de fond (de l') Posologie standard - En cas d'oubli : respecter un intervalle d'au moins 10 jours avec la dose suivante
- 300 mg 1 fois ce jour toutes les 2 semaines
Traitement ultérieur éventuel Dans le cas de : Etat stable - En cas d'oubli : respecter un intervalle d'au moins 24 jours avec la dose suivante
- 300 mg 1 fois ce jour toutes les 4 semaines
Modalités d'administration du traitement- Administrer dans le haut du bras, dans l'abdomen ou dans la cuisse
- Administrer en variant le site d'injection
- Administrer par voie sous-cutanée
- En cas d'oubli : prendre le traitement dès que possible
- Ne pas agiter le flacon
- Produit à usage unique, ne pas réutiliser
- Réservé à l'adulte et à l'enfant de plus de 2 ans
Unité de priseml- lanadélumab : 150 mg
Modalités d'administration- Voie sous-cutanée
- Administrer dans le haut du bras, dans l'abdomen ou dans la cuisse
- Administrer en variant le site d'injection
- En cas d'oubli : prendre le traitement dès que possible
- Ne pas agiter le flacon
Posologie Patient de 2 an(s) à 12 an(s) 10 kg Oedème angioneurotique héréditaire, traitement de fond (de l') Posologie standard - En cas d'oubli : respecter un intervalle d'au moins 24 jours avec la dose suivante
- 150 mg 1 fois ce jour toutes les 4 semaines
Dans le cas de : Réponse insuffisante au traitement - En cas d'oubli : respecter un intervalle d'au moins 17 jours avec la dose suivante
- 150 mg 1 fois ce jour toutes les 3 semaines
20 kg Oedème angioneurotique héréditaire, traitement de fond (de l') Posologie standard - En cas d'oubli : respecter un intervalle d'au moins 10 jours avec la dose suivante
- 150 mg 1 fois ce jour toutes les 2 semaines
Dans le cas de : Etat stable - En cas d'oubli : respecter un intervalle d'au moins 24 jours avec la dose suivante
- 150 mg 1 fois ce jour toutes les 4 semaines
Poids >= 40 kg Oedème angioneurotique héréditaire, traitement de fond (de l') Posologie standard - En cas d'oubli : respecter un intervalle d'au moins 10 jours avec la dose suivante
- 300 mg 1 fois ce jour toutes les 2 semaines
Dans le cas de : Etat stable - En cas d'oubli : respecter un intervalle d'au moins 24 jours avec la dose suivante
- 300 mg 1 fois ce jour toutes les 4 semaines
Patient à partir de 12 an(s) Patient quel que soit le poids Oedème angioneurotique héréditaire, traitement de fond (de l') Posologie standard - En cas d'oubli : respecter un intervalle d'au moins 10 jours avec la dose suivante
- 300 mg 1 fois ce jour toutes les 2 semaines
Traitement ultérieur éventuel Dans le cas de : Etat stable - En cas d'oubli : respecter un intervalle d'au moins 24 jours avec la dose suivante
- 300 mg 1 fois ce jour toutes les 4 semaines
- Voie sous-cutanée
- Administrer dans le haut du bras, dans l'abdomen ou dans la cuisse
- Administrer en variant le site d'injection
- En cas d'oubli : prendre le traitement dès que possible
- Ne pas agiter le flacon
Posologie Patient de 2 an(s) à 12 an(s) 10 kg Oedème angioneurotique héréditaire, traitement de fond (de l') Posologie standard - En cas d'oubli : respecter un intervalle d'au moins 24 jours avec la dose suivante
- 150 mg 1 fois ce jour toutes les 4 semaines
Dans le cas de : Réponse insuffisante au traitement - En cas d'oubli : respecter un intervalle d'au moins 17 jours avec la dose suivante
- 150 mg 1 fois ce jour toutes les 3 semaines
20 kg Oedème angioneurotique héréditaire, traitement de fond (de l') Posologie standard - En cas d'oubli : respecter un intervalle d'au moins 10 jours avec la dose suivante
- 150 mg 1 fois ce jour toutes les 2 semaines
Dans le cas de : Etat stable - En cas d'oubli : respecter un intervalle d'au moins 24 jours avec la dose suivante
- 150 mg 1 fois ce jour toutes les 4 semaines
Poids >= 40 kg Oedème angioneurotique héréditaire, traitement de fond (de l') Posologie standard - En cas d'oubli : respecter un intervalle d'au moins 10 jours avec la dose suivante
- 300 mg 1 fois ce jour toutes les 2 semaines
Dans le cas de : Etat stable - En cas d'oubli : respecter un intervalle d'au moins 24 jours avec la dose suivante
- 300 mg 1 fois ce jour toutes les 4 semaines
Patient à partir de 12 an(s) Patient quel que soit le poids Oedème angioneurotique héréditaire, traitement de fond (de l') Posologie standard - En cas d'oubli : respecter un intervalle d'au moins 10 jours avec la dose suivante
- 300 mg 1 fois ce jour toutes les 2 semaines
Traitement ultérieur éventuel Dans le cas de : Etat stable - En cas d'oubli : respecter un intervalle d'au moins 24 jours avec la dose suivante
- 300 mg 1 fois ce jour toutes les 4 semaines
- En cas d'oubli : respecter un intervalle d'au moins 24 jours avec la dose suivante
- 150 mg 1 fois ce jour toutes les 4 semaines
- En cas d'oubli : respecter un intervalle d'au moins 17 jours avec la dose suivante
- 150 mg 1 fois ce jour toutes les 3 semaines
- En cas d'oubli : respecter un intervalle d'au moins 10 jours avec la dose suivante
- 150 mg 1 fois ce jour toutes les 2 semaines
- En cas d'oubli : respecter un intervalle d'au moins 24 jours avec la dose suivante
- 150 mg 1 fois ce jour toutes les 4 semaines
- En cas d'oubli : respecter un intervalle d'au moins 10 jours avec la dose suivante
- 300 mg 1 fois ce jour toutes les 2 semaines
- En cas d'oubli : respecter un intervalle d'au moins 24 jours avec la dose suivante
- 300 mg 1 fois ce jour toutes les 4 semaines
- En cas d'oubli : respecter un intervalle d'au moins 10 jours avec la dose suivante
- 300 mg 1 fois ce jour toutes les 2 semaines
- En cas d'oubli : respecter un intervalle d'au moins 24 jours avec la dose suivante
- 300 mg 1 fois ce jour toutes les 4 semaines
Modalités d'administration du traitement- Administrer dans le haut du bras, dans l'abdomen ou dans la cuisse
- Administrer en variant le site d'injection
- Administrer par voie sous-cutanée
- En cas d'oubli : prendre le traitement dès que possible
- Ne pas agiter le flacon
- Produit à usage unique, ne pas réutiliser
- Réservé à l'adulte et à l'enfant de plus de 2 ans
INFORMATIONS RELATIVES À LA SÉCURITÉ DU PATIENTLANADELUMAB 300 mg/2 ml sol injNiveau de risque : X Critique III Haut II Modéré I Bas
Contre-indicationsX Critique Niveau de gravité : Contre-indication absolue - Hypersensibilité à l'un des composants
- Hypersensibilité aux protéines de hamster
PrécautionsII Modéré Niveau de gravité : Précautions- Allaitement
- Grossesse
- Oedème angioneurotique héréditaire avec une activité normale de C1Inh
- Sujet de moins de 40 kg
Interactions médicamenteusesSe référer au paragraphe Interactions médicamenteuses de la documentation officielle du produit
Grossesse et allaitement
Contre-indications et précautions d'emploi Grossesse (mois) Allaitement 1 2 3 4 5 6 7 8 9 Risques II II II Précaution
Risques liés au traitement- Risque d'interférence avec les examens de laboratoire
- Risque de réaction d'hypersensibilité
Mesures à associer au traitement- N'est pas indiqué dans le traitement des crises aiguës d'oedème angioneurotique héréditaire
- Traçabilité recommandée
Traitement à arrêter définitivement en cas de...- Traitement à arrêter en cas d'apparition de réaction sévère d'hypersensibilité
Information des professionnels de santé et des patients- Info prof de santé : former le patient ou les proches à la technique de l'auto-injection
Effets indésirables
Systèmes Fréquence de moyenne à élevée (?1/1 000) Fréquence basse ( Fréquence inconnue ANOMALIE DES EXAMENS DE LABORATOIRE ALAT (augmentation) (Fréquent)
ASAT (augmentation) (Fréquent)
Anticorps (production)
DERMATOLOGIE Eruption maculopapuleuse (Fréquent)
Prurit
DIVERS Gêne
IMMUNO-ALLERGOLOGIE Hypersensibilité (Fréquent)
INSTRUMENTATION Réaction au point d'injection (Très fréquent)
Hémorragie au point d'injection
Sensation de chaleur au point d'injection
Paresthésie au point d'injection
Eruption cutanée au point d'injection
Ecchymose au point d'injection
Induration au site d'injection
Oedème au point d'injection
Gonflement au site d'injection
Erythème au point d'injection
Gêne au point d'injection
Prurit au point d'injection
Douleur au point d'injection
Hématome au site d'injection
ORL, STOMATOLOGIE Sensation de vertige (Fréquent)
SYSTÈME DIGESTIF Picotement de la langue
SYSTÈME MUSCULO-SQUELETTIQUE Douleur musculaire (Fréquent)
| Niveau de risque : | X Critique | III Haut | II Modéré | I Bas |
|---|
Contre-indicationsX Critique Niveau de gravité : Contre-indication absolue - Hypersensibilité à l'un des composants
- Hypersensibilité aux protéines de hamster
Niveau de gravité : Contre-indication absolue - Hypersensibilité à l'un des composants
- Hypersensibilité aux protéines de hamster
|
PrécautionsII Modéré Niveau de gravité : Précautions- Allaitement
- Grossesse
- Oedème angioneurotique héréditaire avec une activité normale de C1Inh
- Sujet de moins de 40 kg
Niveau de gravité : Précautions- Allaitement
- Grossesse
- Oedème angioneurotique héréditaire avec une activité normale de C1Inh
- Sujet de moins de 40 kg
|
Interactions médicamenteusesSe référer au paragraphe Interactions médicamenteuses de la documentation officielle du produit
Grossesse et allaitement
| Contre-indications et précautions d'emploi | ||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| ||||||||||||||||||||||||||||||||||||||||||
Risques liés au traitement- Risque d'interférence avec les examens de laboratoire
- Risque de réaction d'hypersensibilité
Mesures à associer au traitement- N'est pas indiqué dans le traitement des crises aiguës d'oedème angioneurotique héréditaire
- Traçabilité recommandée
Traitement à arrêter définitivement en cas de...- Traitement à arrêter en cas d'apparition de réaction sévère d'hypersensibilité
Information des professionnels de santé et des patients- Info prof de santé : former le patient ou les proches à la technique de l'auto-injection
Effets indésirables
| Systèmes | Fréquence de moyenne à élevée (?1/1 000) | Fréquence basse ( | Fréquence inconnue |
|---|---|---|---|
| ANOMALIE DES EXAMENS DE LABORATOIRE | |||
| DERMATOLOGIE | |||
| DIVERS | |||
| IMMUNO-ALLERGOLOGIE | |||
| INSTRUMENTATION | |||
| ORL, STOMATOLOGIE | |||
| SYSTÈME DIGESTIF | |||
| SYSTÈME MUSCULO-SQUELETTIQUE |
lanadélumab
Chimie
| IUPAC | immunoglobuline G1-kappa, anti-[Homo sapiens KLKB1 (kallikréine B 1, prékallikréine plasmatique (zymogène), kininogénine, facteur de Fletcher) clivé protéolytiquement par F12 (facteur FXII), kallikréine plasmatique active (EC 3.4.21.34)], Homo sapiens anticorps monoclonal; chaîne lourde gamma1 (1-451) [Homo sapiens VH (IGHV3-23*03 (91.80%) -(IGHD) -IGHJ3*02) [8.8.15] (1- 122) -IGHG1*03, G1m3 (CH1 (123-220), charnière (221- 235), CH2 (236-345), CH3 (346-450), CHS K2>del (451)) (123-451)], (225-213')-disulfure avec la chaîne légère kappa (1'-213') [Homo sapiens V-KAPPA (IGKV1-5*03 (97.90%) -IGKJ1*01) [6.3.8] (1'-106') -IGKC*01, Km3 (107'- 213')]; dimère (231-231'':234-234'')-bisdisulfure |
|---|---|
| Synonymes | lanadelumab |
Posologie
| Defined Daily Dose (WHO) |
|
|---|
INFORMATIONS RELATIVES À LA SÉCURITÉ DU PATIENTLANADELUMAB 300 mg/2 ml sol injNiveau de risque : X Critique III Haut II Modéré I Bas
Contre-indicationsX Critique Niveau de gravité : Contre-indication absolue - Hypersensibilité à l'un des composants
- Hypersensibilité aux protéines de hamster
PrécautionsII Modéré Niveau de gravité : Précautions- Allaitement
- Grossesse
- Oedème angioneurotique héréditaire avec une activité normale de C1Inh
- Sujet de moins de 40 kg
Interactions médicamenteusesSe référer au paragraphe Interactions médicamenteuses de la documentation officielle du produit
Grossesse et allaitement
Contre-indications et précautions d'emploi Grossesse (mois) Allaitement 1 2 3 4 5 6 7 8 9 Risques II II II Précaution
Risques liés au traitement- Risque d'interférence avec les examens de laboratoire
- Risque de réaction d'hypersensibilité
Mesures à associer au traitement- N'est pas indiqué dans le traitement des crises aiguës d'oedème angioneurotique héréditaire
- Traçabilité recommandée
Traitement à arrêter définitivement en cas de...- Traitement à arrêter en cas d'apparition de réaction sévère d'hypersensibilité
Information des professionnels de santé et des patients- Info prof de santé : former le patient ou les proches à la technique de l'auto-injection
Effets indésirables
Systèmes Fréquence de moyenne à élevée (?1/1 000) Fréquence basse ( Fréquence inconnue ANOMALIE DES EXAMENS DE LABORATOIRE ALAT (augmentation) (Fréquent)
ASAT (augmentation) (Fréquent)
Anticorps (production)
DERMATOLOGIE Eruption maculopapuleuse (Fréquent)
Prurit
DIVERS Gêne
IMMUNO-ALLERGOLOGIE Hypersensibilité (Fréquent)
INSTRUMENTATION Réaction au point d'injection (Très fréquent)
Hémorragie au point d'injection
Sensation de chaleur au point d'injection
Paresthésie au point d'injection
Eruption cutanée au point d'injection
Ecchymose au point d'injection
Induration au site d'injection
Oedème au point d'injection
Gonflement au site d'injection
Erythème au point d'injection
Gêne au point d'injection
Prurit au point d'injection
Douleur au point d'injection
Hématome au site d'injection
ORL, STOMATOLOGIE Sensation de vertige (Fréquent)
SYSTÈME DIGESTIF Picotement de la langue
SYSTÈME MUSCULO-SQUELETTIQUE Douleur musculaire (Fréquent)
| Niveau de risque : | X Critique | III Haut | II Modéré | I Bas |
|---|
Contre-indicationsX Critique Niveau de gravité : Contre-indication absolue - Hypersensibilité à l'un des composants
- Hypersensibilité aux protéines de hamster
Niveau de gravité : Contre-indication absolue - Hypersensibilité à l'un des composants
- Hypersensibilité aux protéines de hamster
|
PrécautionsII Modéré Niveau de gravité : Précautions- Allaitement
- Grossesse
- Oedème angioneurotique héréditaire avec une activité normale de C1Inh
- Sujet de moins de 40 kg
Niveau de gravité : Précautions- Allaitement
- Grossesse
- Oedème angioneurotique héréditaire avec une activité normale de C1Inh
- Sujet de moins de 40 kg
|
Interactions médicamenteusesSe référer au paragraphe Interactions médicamenteuses de la documentation officielle du produit
Grossesse et allaitement
| Contre-indications et précautions d'emploi | ||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| ||||||||||||||||||||||||||||||||||||||||||
Risques liés au traitement- Risque d'interférence avec les examens de laboratoire
- Risque de réaction d'hypersensibilité
Mesures à associer au traitement- N'est pas indiqué dans le traitement des crises aiguës d'oedème angioneurotique héréditaire
- Traçabilité recommandée
Traitement à arrêter définitivement en cas de...- Traitement à arrêter en cas d'apparition de réaction sévère d'hypersensibilité
Information des professionnels de santé et des patients- Info prof de santé : former le patient ou les proches à la technique de l'auto-injection
Effets indésirables
| Systèmes | Fréquence de moyenne à élevée (?1/1 000) | Fréquence basse ( | Fréquence inconnue |
|---|---|---|---|
| ANOMALIE DES EXAMENS DE LABORATOIRE | |||
| DERMATOLOGIE | |||
| DIVERS | |||
| IMMUNO-ALLERGOLOGIE | |||
| INSTRUMENTATION | |||
| ORL, STOMATOLOGIE | |||
| SYSTÈME DIGESTIF | |||
| SYSTÈME MUSCULO-SQUELETTIQUE |
Voir aussi les substances
Lanadélumab
Chimie
| IUPAC | immunoglobuline G1-kappa, anti-[Homo sapiens KLKB1 (kallikréine B 1, prékallikréine plasmatique (zymogène), kininogénine, facteur de Fletcher) clivé protéolytiquement par F12 (facteur FXII), kallikréine plasmatique active (EC 3.4.21.34)], Homo sapiens anticorps monoclonal; chaîne lourde gamma1 (1-451) [Homo sapiens VH (IGHV3-23*03 (91.80%) -(IGHD) -IGHJ3*02) [8.8.15] (1- 122) -IGHG1*03, G1m3 (CH1 (123-220), charnière (221- 235), CH2 (236-345), CH3 (346-450), CHS K2>del (451)) (123-451)], (225-213')-disulfure avec la chaîne légère kappa (1'-213') [Homo sapiens V-KAPPA (IGKV1-5*03 (97.90%) -IGKJ1*01) [6.3.8] (1'-106') -IGKC*01, Km3 (107'- 213')]; dimère (231-231'':234-234'')-bisdisulfure |
|---|---|
| Synonymes | lanadelumab |
Posologie
| Defined Daily Dose (WHO) |
|
|---|