Veuillez saisir au moins 3 caractères pour votre recherche.
- Médicaments
- VIMKUNYA
- VIMKUNYA susp inj ser préremplie
Sommaire
Cip : 3400930313398
Modalités de conservation : Avant ouverture : 2° < t < 8° durant 36 mois (Conserver à l'abri de la lumière, Conserver au réfrigérateur, Conserver dans son emballage, Ne pas congeler)
FORMES et PRÉSENTATIONS |
Suspension injectable (avant agitation, le vaccin est un liquide limpide contenant un précipité blanc ; pH : 6,6-8,2 ; osmolalité : 320-390 mOsmol/kg).
Seringue préremplie (en verre) unidose contenant 0,8 mL de suspension, avec adaptateur Luer-lock, capuchon rigide et bouchon.
Boîte de 1, sans aiguille, dans une coque protectrice.
COMPOSITION |
Une dose (0,8 mL) contient 40 microgrammes de pseudo-particules virales1,2 (PPV) apparentées aux protéines du virus du chikungunya (CHIKV) adsorbées sur de l'hydroxyde d'aluminium hydraté.
1 produites dans des cellules rénales embryonnaires humaines par la technologie de l'ADN recombinant.
2 issues de la souche sénégalaise 37 997 du CHIKV, constituées d'une protéine de capside (C) et de protéines d'enveloppe E1 et E2 du CHIKV.
Hydroxyde d'aluminium hydraté (environ 300 microgrammes d'Al3+ par dose de 0,8 mL).
Saccharose, phosphate dipotassique, dihydrogénophosphate de potassium, citrate de sodium, eau pour préparations injectables
Pour l'adsorbant, voir ci-dessus.
INDICATIONS |
VIMKUNYA est indiqué dans l'immunisation active pour la prévention de la maladie causée par le virus du chikungunya (CHIKV) chez les personnes âgées de 12 ans et plus.
Ce vaccin doit être utilisé conformément aux recommandations officielles.
POSOLOGIE ET MODE D'ADMINISTRATION |
Connectez-vous pour accéder à ce contenu
CONTRE-INDICATIONS |
Connectez-vous pour accéder à ce contenu
MISES EN GARDE et PRÉCAUTIONS D'EMPLOI |
Traçabilité
Afin d'améliorer la traçabilité des médicaments biologiques, le nom et le numéro de lot du produit administré doivent être clairement enregistrés.
Hypersensibilité et anaphylaxie
Un traitement médical approprié pour la prise en charge des réactions allergiques immédiates doit être tenu à disposition au cas où une réaction anaphylactique aiguë surviendrait après l'administration de VIMKUNYA.
Personnes immunodéprimées
La sécurité et l'efficacité de VIMKUNYA n'ont pas été évaluées chez les patients présentant une immunodéficience et ceux utilisant des traitements immunosuppresseurs par voie systémique. On ne sait pas si la réponse induite par la vaccination chez les personnes dont les capacités de réponse immunitaire sont altérées, y compris celles recevant un traitement immunosuppresseur, sera la même que chez les personnes immunocompétentes.
Réactions liées à l'anxiété
Comme avec tout vaccin injectable, des réactions liées à l'anxiété, y compris des réactions vaso-vagales (syncope), une hyperventilation ou des réactions liées au stress, peuvent se produire en association avec la vaccination, reflétant une réponse psychogène à l'injection avec une aiguille. Il est important de prendre des précautions pour éviter toute blessure en cas d'évanouissement.
Maladie concomitante
La vaccination doit être reportée chez les personnes présentant une maladie fébrile aiguë sévère ou une infection aiguë. La présence d'une infection mineure et/ou d'une faible fièvre ne doit pas retarder la vaccination.
Thrombocytopénie et troubles de la coagulation
Comme avec les autres injections intramusculaires, le vaccin doit être administré avec précaution aux personnes recevant un traitement anticoagulant ou celles présentant une thrombopénie ou un quelconque trouble de la coagulation (tel qu'une hémophilie) car des saignements ou des ecchymoses pourraient survenir après une injection intramusculaire chez ces personnes.
Limites d'efficacité du vaccin
Comme avec tout vaccin, la réponse protectrice peut ne pas être obtenue chez toutes les personnes après la vaccination. Il est recommandé de continuer à prendre des mesures de protection individuelle contre les piqûres de moustique après la vaccination.
Excipients
Potassium
Ce vaccin contient moins de 1 mmol (39 mg) de potassium par dose, c.-à-d. qu'il est essentiellement « sans potassium ».
Sodium
Ce vaccin contient moins de 1 mmol (23 mg) de sodium par dose, c.-à-d. qu'il est essentiellement « sans sodium ».
INTERACTIONS |
Connectez-vous pour accéder à ce contenu
FERTILITÉ/GROSSESSE/ALLAITEMENT |
Grossesse
Lors des études effectuées chez l'animal, aucun effet lié au vaccin sur le développement embryo-fœtal n'a été observé chez le rat et le lapin ; certains effets post-natals, dont la pertinence clinique n'est pas connue, ont été observés chez le lapin uniquement (voir rubrique Sécurité préclinique).
Il existe des données limitées sur l'utilisation de VIMKUNYA chez la femme enceinte. Ces données sont insuffisantes pour permettre de conclure sur l'absence d'effets potentiels de VIMKUNYA sur la grossesse, le développement embryofœtal, l'accouchement et le développement post-natal.
La décision d'administrer VIMKUNYA pendant la grossesse devra être prise en tenant compte du risque individuel d'exposition au CHIKV de type sauvage, de l'âge gestationnel et des risques pour le fœtus ou le nouveau-né.
Allaitement
On ne sait pas si VIMKUNYA est excrété dans le lait maternel. Un risque pour l'enfant allaité ne peut être exclu. Les bénéfices de l'allaitement pour le développement et la santé de l'enfant devront être pris en compte en regard de la nécessité clinique d'utiliser VIMKUNYA chez la mère et des effets indésirables éventuels de VIMKUNYA chez l'enfant allaité.
Fertilité
Aucune étude spécifique n'a été réalisée concernant la fertilité.
Les études effectuées chez l'animal n'ont pas mis en évidence d'effets délétères directs ou indirects sur la fertilité des femelles (voir rubrique Sécurité préclinique).
CONDUITE et UTILISATION DE MACHINES |
Aucune étude n'a été réalisée concernant les effets sur l'aptitude à conduire des véhicules ou à utiliser des machines. Cependant, certains des effets mentionnés dans la rubrique Effets indésirables pourraient altérer temporairement l'aptitude à conduire des véhicules ou à utiliser des machines.
EFFETS INDÉSIRABLES |
Connectez-vous pour accéder à ce contenu
SURDOSAGE |
Aucun cas de surdosage n'a été rapporté au cours des études cliniques. En cas de surdosage, une surveillance des fonctions vitales et un éventuel traitement symptomatique sont recommandés.
PHARMACODYNAMIE |
Connectez-vous pour accéder à ce contenu
SÉCURITÉ PRÉCLINIQUE |
Les données non cliniques issues des études conventionnelles de toxicologie en administration répétée et de tolérance locale n'ont pas révélé de risque particulier pour l'homme.
Toxicité sur les fonctions de reproduction
Des études de toxicologie sur les fonctions de reproduction et de développement ont été réalisées chez des lapines et des rates en administrant plusieurs doses de VIMKUNYA avant l'accouplement et pendant la gestation. Aucun effet indésirable lié au vaccin sur la fertilité des femelles ou le développement embryo-fœtal n'a été observé quelle que soit l'espèce. Une diminution de l'indice de survie postnatale a été observée chez le lapin mais pas chez le rat ; la pertinence de cette observation pour l'être humain n'est pas connue.
INCOMPATIBILITÉS |
En l'absence d'études de compatibilité, le vaccin ne doit pas être mélangé avec d'autres médicaments.
DURÉE DE CONSERVATION |
3 ans
PRÉCAUTIONS PARTICULIÈRES DE CONSERVATION |
À conserver au réfrigérateur (entre 2 °C et 8 °C).
Ne pas congeler.
Conserver la seringue dans l'emballage extérieur, à l'abri de la lumière.
Les données de stabilité indiquent que le vaccin reste stable pendant 4 heures lorsqu'il est conservé à une température comprise entre 8 °C et 25 °C et pendant au moins 24 heures lorsqu'il est conservé entre 0 °C et 2 °C. À l'issue de ce délai, VIMKUNYA doit être utilisé immédiatement ou être éliminé. Ces données sont fournies uniquement pour guider les professionnels de la santé en cas d'excursion temporaire de température.
PRÉCAUTIONS PARTICULIÈRES D'ÉLIMINATION ET DE MANIPULATION |
Tenir ce vaccin hors de la vue et de la portée des enfants.
Instructions de manipulation et administration
Le vaccin doit être manipulé par un professionnel de la santé en utilisant une technique aseptique afin de préserver la stérilité de la dose.
Ne pas mélanger VIMKUNYA avec un autre vaccin dans la même seringue ou le même flacon.
Préparation avant utilisation
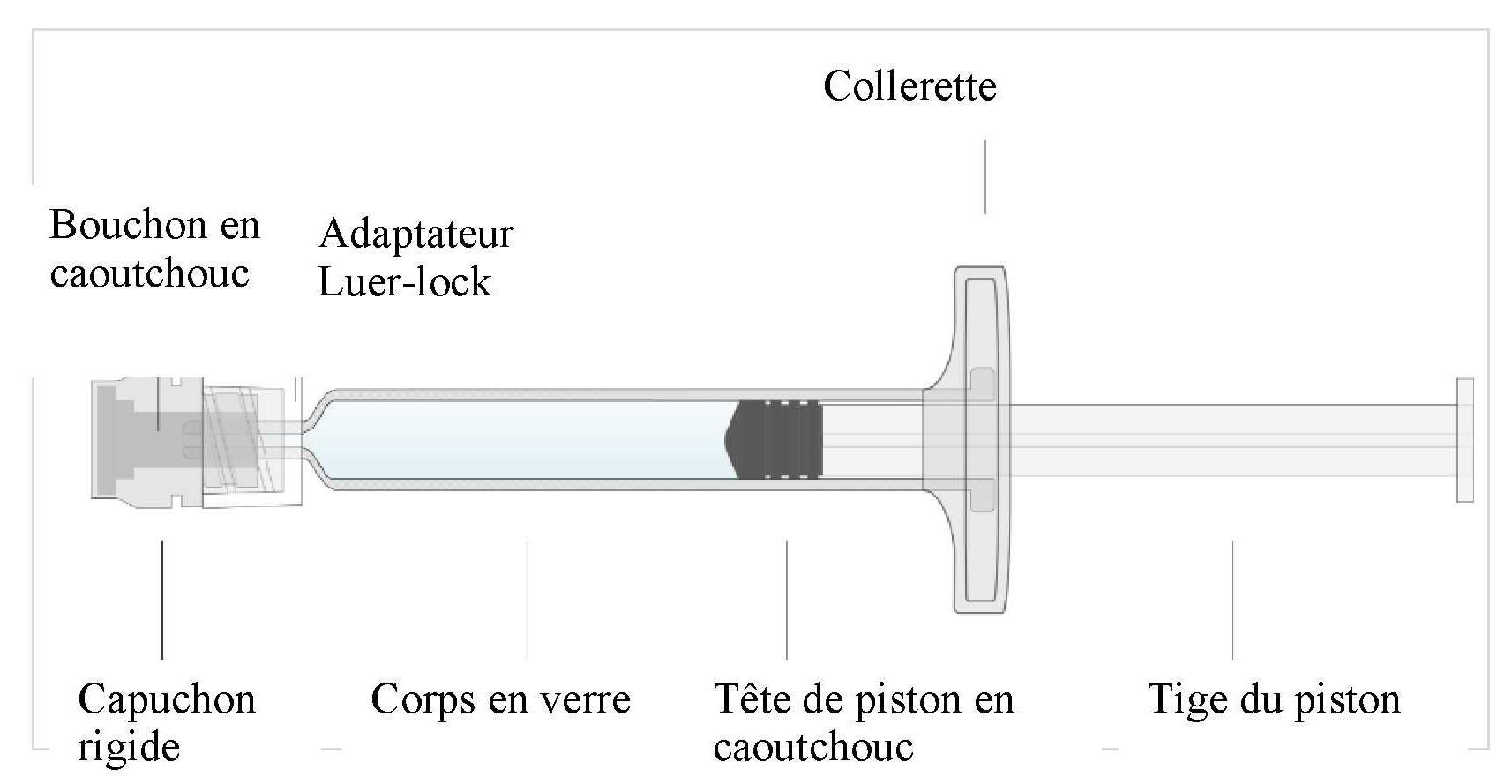
Inspecter la seringue préremplie
Administrer le vaccin
Jeter le produit
Élimination
PRESCRIPTION/DÉLIVRANCE/PRISE EN CHARGE |
| AMM |
|
Collect. dans l’indication Immunisation active pour la prévention de la maladie causée par le virus du chikungunya (CHIKV) chez les personnes âgées de 12 ans et plus. Ce vaccin doit être utilisé conformément aux recommandations du Haut Conseil de la santé publique en vigueur (recommandations sanitaires 2025 aux voyageurs).
Titulaire de l'AMM : Bavarian Nordic A/S, Philip Heymans Alle 3, D-2900 Hellerup, Danemark.



VIMKUNYA, ARTESUNATE AMIVAS : prise en charge dans le droit commun, à l'hôpital

Vaccination contre le chikungunya des personnes de 65 ans et plus : pas de changement en France