Veuillez saisir au moins 3 caractères pour votre recherche.
- Médicaments
- IXIARO
- IXIARO susp inj
Sommaire
EEN sans dose seuil : sodium métabisulfite
Cip : 3400939395975
Modalités de conservation : Avant ouverture : 2° < t < 8° durant 36 mois (Conserver à l'abri de la lumière, Conserver dans son emballage, Conserver au réfrigérateur, Ne pas congeler)
FORMES et PRÉSENTATIONS |
Suspension injectable (liquide transparent avec un précipité blanc).
Seringue préremplie de 0,5 ml de suspension, avec bouchon-piston, sans aiguille. Boîte de 1.
COMPOSITION |
1 dose (0,5 ml) d'IXIARO contient :
1 Produite sur cellules Vero.
2 Adsorbée sur hydroxyde d'aluminium hydraté (environ 0,25 milligramme d'Al3+).
3 Unités antigène.
Excipients à effet notoire :
Ce médicament contient moins de 1 mmol (39 mg) de potassium par dose unique de 0,5 ml et moins de 1 mmol (23 mg) de sodium par dose unique de 0,5 ml, c.-à-d. qu'il est essentiellement « sans potassium » et « sans sodium ».
Ce produit peut contenir des traces résiduelles de métabisulfite de sodium, inférieures au seuil de détection.
La composition en sels de la solution saline tamponnée phosphate 0,0067 M (en PO4) est comme suit :
Solution saline tamponnée phosphate composée de : chlorure de sodium, phosphate monopotassique, phosphate disodique, eau pour préparations injectables.
Pour l'adjuvant, voir ci-dessus.
INDICATIONS |
IXIARO est indiqué pour l'immunisation active contre l'encéphalite japonaise chez l'adulte, l'adolescent, l'enfant et le nourrisson de plus de 2 mois.
L'administration d'IXIARO doit être envisagée chez les sujets exposés à un risque d'infection par le virus lors d'un voyage ou dans le cadre de leur activité professionnelle.
POSOLOGIE ET MODE D'ADMINISTRATION |
Connectez-vous pour accéder à ce contenu
CONTRE-INDICATIONS |
Connectez-vous pour accéder à ce contenu
MISES EN GARDE et PRÉCAUTIONS D'EMPLOI |
Traçabilité : Afin d'améliorer la traçabilité des médicaments biologiques, le nom et le numéro de lot du produit administré doivent être clairement enregistrés.
Comme avec tous les vaccins injectables, il est recommandé de toujours disposer d'un traitement médical approprié et d'assurer une surveillance afin de traiter les rares cas de réaction anaphylactique survenant après l'administration du vaccin.
IXIARO ne doit en aucun cas être administré par voie intravasculaire.
Comme tous les vaccins, IXIARO peut ne pas protéger tous les sujets vaccinés.
IXIARO ne protège pas de l'encéphalite causée par d'autres micro-organismes.
Comme pour toute injection intramusculaire, ce vaccin ne doit pas être administré par voie intramusculaire chez les sujets présentant une thrombocytopénie, une hémophilie ou un risque d'hémorragies (voir rubrique Posologie et mode d'administration).
Chez l'adulte, des taux de séroconversion de 29,4 % et 97,3 % ont été respectivement observés 10 jours après la première dose par voie i.m. et une semaine après la seconde dose par voie i.m selon le schéma conventionnel. Après une immunisation selon le schéma rapide, un taux de séroconversion de 99 % a été observé 7 jours après la seconde dose par voie i.m. Par conséquent, la primo-vaccination doit être achevée au minimum une semaine avant l'exposition potentielle au virus de l'encéphalite japonaise (VEJ).
La protection contre l'encéphalite japonaise n'est pas assurée tant que la seconde dose n'a pas été administrée.
INTERACTIONS |
Connectez-vous pour accéder à ce contenu
FERTILITÉ/GROSSESSE/ALLAITEMENT |
Grossesse
Il existe peu de données sur l'utilisation d'IXIARO pendant la grossesse. Des données de pertinence clinique incertaine ont été obtenues dans des études menées chez l'animal (voir rubrique Sécurité préclinique). Par mesure de précaution, l'utilisation d'IXIARO doit être évitée pendant la grossesse.
Allaitement
On ne sait pas si IXIARO est excrété dans le lait humain.
Aucun effet sur le nouveau-né/le nourrisson allaité n'est anticipé, étant donné que l'exposition systémique de la femme allaitante à IXIARO est négligeable. Cependant, en l'absence de données et par mesure de précaution, l'utilisation d'IXIARO doit être évitée pendant l'allaitement.
Fertilité
Une étude menée chez le rat n'a pas mis en évidence d'effets du vaccin sur la reproduction féminine, le poids fœtal, la survie et le développement de la descendance.
CONDUITE et UTILISATION DE MACHINES |
IXIARO n'a aucun effet ou qu'un effet négligeable sur l'aptitude à conduire des véhicules ou à utiliser des machines.
EFFETS INDÉSIRABLES |
Connectez-vous pour accéder à ce contenu
SURDOSAGE |
Aucun symptôme inhérent au surdosage n'a été rapporté.
Population pédiatrique :
Aucun cas de surdosage n'a été rapporté dans la population pédiatrique. L'administration, par inadvertance, d'une dose de 0,5 ml d'IXIARO chez des enfants âgés de 1 à 3 ans ne pose pas de problème de sécurité (voir rubrique Pharmacodynamie).
PHARMACODYNAMIE |
Connectez-vous pour accéder à ce contenu
PHARMACOCINÉTIQUE |
Connectez-vous pour accéder à ce contenu
SÉCURITÉ PRÉCLINIQUE |
Les données relatives à la toxicité préclinique sont limitées.
Dans une étude de toxicité sur la reproduction et le développement pré-/post-natal, aucun effet délétère associé au vaccin sur la reproduction, le poids fœtal, la survie et le développement de l'enfant n'a été détecté. Une ossification incomplète de plusieurs parties du squelette a toutefois été observée dans le groupe recevant 2 doses, mais pas dans le groupe recevant 3 doses. Il est pour l'instant difficile de déterminer si ce phénomène est ou non lié au traitement.
INCOMPATIBILITÉS |
En l'absence d'études de compatibilité, ce médicament ne doit pas être mélangé avec d'autres médicaments.
DURÉE DE CONSERVATION |
3 ans
PRÉCAUTIONS PARTICULIÈRES DE CONSERVATION |
À conserver au réfrigérateur (entre 2 °C et 8 °C). Ne pas congeler. À conserver dans l'emballage d'origine à l'abri de la lumière.
PRÉCAUTIONS PARTICULIÈRES D'ÉLIMINATION ET DE MANIPULATION |
La seringue préremplie est à usage unique ; elle ne doit pas être utilisée pour plus d'une personne. La seringue préremplie est prête à l'emploi. Si l'aiguille n'est pas fournie, utiliser une aiguille stérile.
Ne pas utiliser le vaccin si l'emballage en aluminium n'est pas intact ou si le conditionnement est endommagé.
Lors de la conservation du vaccin, un fin dépôt de couleur blanche et un surnageant incolore transparent peuvent être observés.
Avant l'administration, bien agiter la seringue pour obtenir une suspension blanche, opaque et homogène. Ne pas administrer si le produit comporte des particules après avoir été agité, si une décoloration est observée ou si la seringue paraît endommagée.
Tout médicament non utilisé ou déchet doit être éliminé conformément à la réglementation locale en vigueur.
Informations sur l'administration d'une dose de 0,5 ml d'IXIARO chez les personnes âgées de 3 ans et plus
Pour l'administration de la totalité de la dose de 0,5 ml, suivre les étapes suivantes :
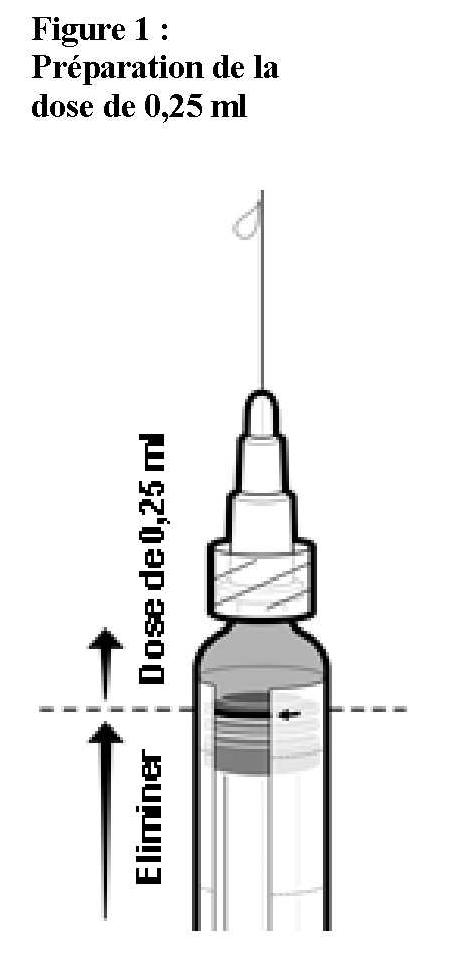
Informations sur la préparation d'une dose de 0,25 ml d'IXIARO pour les enfants âgés de moins de 3 ans
Pour l'administration d'une dose de 0,25 ml chez des enfants âgés de 2 mois à moins de 3 ans, suivre les étapes suivantes :
* Si vous dépassez la ligne rouge lorsque vous appuyez sur le bouton-piston, la dose de 0,25 ml n'est plus garantie. Une nouvelle seringue doit donc être utilisée.
PRESCRIPTION/DÉLIVRANCE/PRISE EN CHARGE |
| AMM |
|