Veuillez saisir au moins 3 caractères pour votre recherche.
- Médicaments
- ENERZAIR BREEZHALER
- ENERZAIR BREEZHALER 114 µg/46 µg/136 µg pdre p inhal en gél
Sommaire
enveloppe de la gélule : hypromellose, carraghénates, potassium chlorure, eau purifiée
colorant (gélule) : fer jaune oxyde, indigotine
encre d'impression : fer noir oxyde, alcool isopropylique, propylèneglycol
EEN sans dose seuil : lactose monohydrate
Cip : 3400930208892
Modalités de conservation : Avant ouverture : durant 36 mois (Conserver à l'abri de la lumière, Conserver dans son emballage, Conserver à l'abri de l'humidité)
Cip : 3400930208878
Modalités de conservation : Avant ouverture : durant 36 mois (Conserver à l'abri de la lumière, Conserver dans son emballage, Conserver à l'abri de l'humidité)
Cip : 3400930208908
Modalités de conservation : Avant ouverture : durant 36 mois (Conserver à l'abri de la lumière, Conserver dans son emballage, Conserver à l'abri de l'humidité)
FORMES et PRÉSENTATIONS |
Poudre pour inhalation (blanche) en gélule (coiffe verte transparente et corps incolore transparent ; portant le code produit « IGM150-50-160 » imprimé en noir au-dessus de deux lignes noires sur le corps de la gélule et le logo du produit imprimé en noir et entouré par une ligne noire sur la coiffe).
Boîte de 10 gélules, sous plaquette prédécoupée unitaire, avec 1 inhalateur.
Boîte de 30 gélules, sous plaquettes prédécoupées unitaires de 10, avec 1 inhalateur.
COMPOSITION |
Chaque gélule contient 150 mcg d'indacatérol (sous forme d'acétate), 63 mcg de bromure de glycopyrronium équivalant à 50 mcg de glycopyrronium et 160 mcg de furoate de mométasone.
Chaque dose délivrée à la sortie de l'embout buccal de l'inhalateur contient 114 mcg d'indacatérol (sous forme d'acétate), 58 mcg de bromure de glycopyrronium équivalant à 46 mcg de glycopyrronium et 136 mcg de furoate de mométasone.
Excipient à effet notoire :
Chaque gélule contient 25 mg de lactose (monohydraté).
Contenu de la gélule : lactose monohydraté, stéarate de magnésium.
Enveloppe de la gélule : hypromellose, carraghénanes, chlorure de potassium, oxyde de fer jaune (E172), carmin d'indigo (E132), eau purifiée.
Encre d'impression : eau purifiée, oxyde de fer noir (E172), alcool isopropylique, propylène glycol (E1520), hypromellose (E464).
INDICATIONS |
Enerzair Breezhaler est indiqué en traitement continu de l'asthme chez les adultes, insuffisamment contrôlés par un traitement continu associant une dose forte de corticoïde inhalé et un bêta-2-agoniste de longue durée d'action, qui ont présenté une ou plusieurs exacerbations de l'asthme au cours de l'année précédente.
POSOLOGIE ET MODE D'ADMINISTRATION |
Connectez-vous pour accéder à ce contenu
CONTRE-INDICATIONS |
Connectez-vous pour accéder à ce contenu
MISES EN GARDE et PRÉCAUTIONS D'EMPLOI |
Aggravation de la maladie
Ce médicament ne devra pas être utilisé pour le traitement des symptômes aigus de l'asthme, y compris les épisodes aigus de bronchospasme. Dans ces situations il convient d'avoir recours à un bronchodilatateur de courte durée d'action. Une augmentation de la consommation de bronchodilatateurs de courte durée d'action pour soulager les symptômes indique une détérioration du contrôle de l'asthme et les patients doivent consulter un médecin.
Les patients ne doivent pas arrêter le traitement sans demander l'avis d'un médecin, les symptômes pourraient réapparaître à l'arrêt du traitement.
Il est recommandé de ne pas arrêter brutalement le traitement par ce médicament. Si les patients ne ressentent pas une efficacité de leur traitement, ils ne doivent pas l'interrompre mais consulter un médecin. L'augmentation de la consommation de bronchodilatateurs de secours indique une aggravation de l'asthme qui justifie une réévaluation du traitement. Une détérioration soudaine et progressive des symptômes de l'asthme peut potentiellement engager le pronostic vital et nécessiter une consultation médicale en urgence.
Hypersensibilité
Des réactions immédiates d'hypersensibilité ont été observées après l'administration de ce médicament. En cas d'apparition de signes évocateurs de réactions allergiques, en particulier un angiœdème (incluant des difficultés respiratoires ou des troubles de la déglutition, un gonflement de la langue, des lèvres et du visage), une urticaire ou une éruption cutanée, le traitement doit être immédiatement interrompu et un traitement alternatif doit être instauré.
Bronchospasme paradoxal
Comme avec tout médicament administré par voie inhalée, l'administration de ce médicament peut entraîner un bronchospasme paradoxal pouvant engager le pronostic vital. En cas de survenue d'un bronchospasme paradoxal, le traitement doit être immédiatement arrêté et un traitement alternatif doit être instauré.
Effets cardiovasculaires
Comme d'autres médicaments contenant des agonistes bêta-2-adrénergiques, ce médicament peut induire chez certains patients un effet cardiovasculaire cliniquement significatif se traduisant par des augmentations de la fréquence cardiaque, de la pression artérielle et/ou des symptômes. Si de tels effets se produisent, il peut être nécessaire d'interrompre le traitement.
Ce médicament doit être utilisé avec prudence chez les patients présentant des affections cardiovasculaires (coronaropathie, infarctus aigu du myocarde, arythmies cardiaques, hypertension), des antécédents de convulsion ou une thyrotoxicose et chez les patients présentant une réponse idiosyncrasique aux bêta-2-agonistes.
Les patients ayant un angor instable, un antécédent d'infarctus du myocarde au cours des 12 derniers mois, une insuffisance ventriculaire gauche de classe NYHA III/IV (New York Heart Association), une arythmie, une hypertension non contrôlée, une maladie cérébrovasculaire ou un antécédent de syndrome du QT long et les patients traités par des médicaments connus pour allonger l'intervalle QTc ont été exclus des études du programme de développement clinique de l'indacatérol/glycopyrronium/furoate de mométasone. Par conséquent, les données concernant la sécurité d'emploi dans ces populations sont considérées comme inconnues.
Si des modifications de l'électrocardiogramme (ECG) telles qu'un aplatissement de l'onde T, un allongement de l'intervalle QT et un sous-décalage du segment ST ont été rapportées avec les bêta-2-agonistes, la pertinence clinique de ces observations est inconnue.
Les bêta-2-agonistes de longue durée d'action (LABA) ou les associations de substances actives contenant des LABA telles qu'Enerzair Breezhaler doivent par conséquent être utilisés avec prudence chez les patients ayant un allongement de l'intervalle QT connu ou suspecté ou chez les patients traités par des médicaments ayant un effet sur l'intervalle QT.
Hypokaliémie avec les bêta-agonistes
Les bêta-2-agonistes peuvent induire chez certains patients une hypokaliémie significative, pouvant entraîner des effets indésirables cardiovasculaires. La diminution de la kaliémie est généralement transitoire et ne nécessite pas de supplémentation. Chez les patients présentant un asthme sévère, les effets hypokaliémiants peuvent être potentialisés par l'hypoxie et par des traitements concomitants, ce qui peut accroître la prédisposition au risque d'arythmies cardiaques (voir rubrique Interactions).
Aucun cas d'hypokaliémie significative n'a été observé dans les études cliniques de l'indacatérol/glycopyrronium/furoate de mométasone à la dose thérapeutique recommandée.
Hyperglycémie
L'inhalation de doses élevées de bêta-2-agonistes et de corticoïdes peut induire une augmentation de la glycémie. La glycémie doit être plus étroitement surveillée chez les patients diabétiques dès l'instauration du traitement.
Ce médicament n'a pas été étudié chez les patients présentant un diabète de type I ou un diabète de type II insuffisamment contrôlé.
Effets anticholinergiques liés au glycopyrronium
Comme les autres médicaments anticholinergiques, ce médicament doit être utilisé avec précaution chez les patients présentant un glaucome à angle fermé ou une rétention urinaire.
Il convient d'informer les patients des signes et symptômes évocateurs d'un glaucome aigu par fermeture de l'angle et de les avertir qu'ils doivent arrêter le traitement et contacter immédiatement leur médecin en cas d'apparition de l'un de ces signes ou symptômes.
Patients présentant une insuffisance rénale sévère
Chez les patients présentant une insuffisance rénale sévère (débit de filtration glomérulaire estimé inférieur à 30 ml/min/1,73 m2) ou en phase terminale sous dialyse, la prudence est requise (voir rubriques Posologie et mode d'administration et Pharmacocinétique).
Prévention des infections oropharyngées
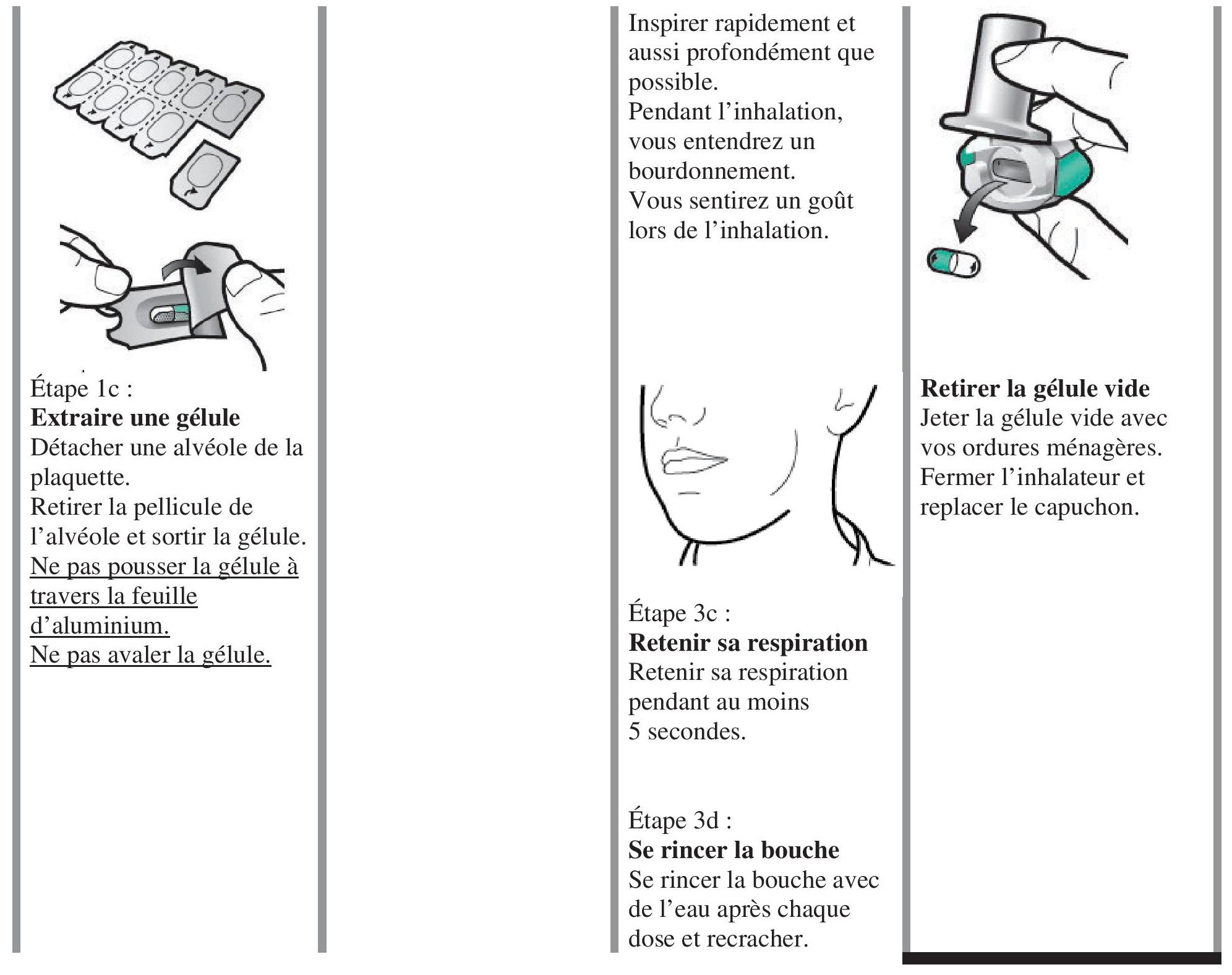
Afin de réduire le risque d'infection oropharyngée à candida, il sera recommandé aux patients de se rincer la bouche ou de se gargariser avec de l'eau sans l'avaler ou de se brosser les dents après l'inhalation de chaque dose.
Effets systémiques liés à la corticothérapie
Les effets systémiques liés aux corticoïdes inhalés peuvent survenir, en particulier lors de traitements à fortes doses pendant de longues périodes. Ces effets sont beaucoup moins susceptibles de se produire qu'avec une corticothérapie orale et les effets peuvent varier d'un patient à l'autre et selon les différentes préparations de corticoïdes.
Les effets systémiques possibles peuvent inclure un syndrome de Cushing, des manifestations cushingoïdes, une inhibition de la fonction surrénalienne, un retard de croissance chez les enfants et les adolescents, une diminution de la densité minérale osseuse, une cataracte, un glaucome et, plus rarement, des troubles psychologiques ou comportementaux incluant une hyperactivité psychomotrice, des troubles du sommeil, une anxiété, une dépression ou un comportement agressif (en particulier chez les enfants). Il est donc important que la dose de corticoïde inhalé soit ajustée à la plus faible dose avec laquelle un contrôle efficace de l'asthme est maintenu.
Des troubles visuels peuvent être rapportés avec l'utilisation de corticoïdes systémiques et topiques (y compris par voie intranasale, inhalée et intraoculaire). Les patients présentant des symptômes tels qu'une vision trouble ou d'autres troubles visuels, doivent être orientés vers un ophtalmologue pour une évaluation des causes possibles des troubles visuels, qui peuvent inclure une cataracte, un glaucome ou des affections rares telles qu'une choriorétinopathie séreuse centrale (CSCR) qui a été rapportée après l'utilisation de corticoïdes systémiques et topiques.
Ce médicament doit être administré avec précaution chez les patients présentant une tuberculose pulmonaire ou chez les patients présentant des infections chroniques ou non traitées.
Excipients
Ce médicament contient du lactose. Les patients présentant une intolérance au galactose, un déficit total en lactase ou un syndrome de malabsorption du glucose et du galactose (maladies héréditaires rares) ne doivent pas prendre ce médicament.
INTERACTIONS |
Connectez-vous pour accéder à ce contenu
FERTILITÉ/GROSSESSE/ALLAITEMENT |
Grossesse
Les données concernant l'utilisation d'Enerzair Breezhaler ou de ses composants individuels (indacatérol, glycopyrronium et furoate de mométasone) chez la femme enceinte sont insuffisantes pour déterminer s'il existe un risque.
L'indacatérol et le glycopyrronium n'ont pas été tératogènes chez le rat et le lapin après administration respectivement par voie sous-cutanée ou par voie inhalée (voir rubrique Sécurité préclinique). Dans les études de reproduction chez des souris, des rates et des lapines gravides, le furoate de mométasone a augmenté les malformations fœtales et diminué la survie et la croissance des fœtus.
Comme les autres médicaments contenant des agonistes bêta-2-adrénergiques, l'indacatérol peut inhiber le travail au moment de l'accouchement par effet relaxant sur le muscle lisse utérin.
Ce médicament ne doit être utilisé durant la grossesse que si le bénéfice attendu pour la patiente justifie le risque potentiel pour le fœtus.
Allaitement
Il n'existe pas de données disponibles sur la présence de l'indacatérol, du glycopyrronium ou du furoate de mométasone dans le lait maternel, ni sur les effets sur le nourrisson allaité ou les effets sur la production de lait. D'autres corticoïdes inhalés similaires au furoate de mométasone passent dans le lait maternel. L'indacatérol, le glycopyrronium et le furoate de mométasone ont été détectés dans le lait de rates allaitantes. Le glycopyrronium a atteint des concentrations jusqu'à 10 fois plus élevées dans le lait des rates allaitantes que dans le sang des mères après administration intraveineuse.
Une décision doit être prise soit d'interrompre l'allaitement soit d'interrompre/de s'abstenir du traitement, en prenant en compte le bénéfice de l'allaitement pour l'enfant au regard du bénéfice du traitement pour la femme.
Fertilité
Les études de reproduction et les autres données chez l'animal n'indiquent pas d'effet indésirable sur la fertilité chez les mâles ou les femelles.
CONDUITE et UTILISATION DE MACHINES |
Ce médicament n'a aucun effet ou un effet négligeable sur l'aptitude à conduire des véhicules et à utiliser des machines.
EFFETS INDÉSIRABLES |
Connectez-vous pour accéder à ce contenu
SURDOSAGE |
Une surveillance et un traitement symptomatique sont préconisés en cas de suspicion de surdosage.
En cas de surdosage les signes, symptômes ou effets indésirables attendus sont ceux associés à l'activité pharmacodynamique des composants individuels (par exemple, tachycardie, tremblements, palpitations, céphalées, nausées, vomissements, somnolence, arythmies ventriculaires, acidose métabolique, hypokaliémie, hyperglycémie, augmentation de la pression oculaire [provoquant une douleur, des troubles de la vision ou une rougeur de l'œil], constipation ou dysuries, inhibition de l'axe hypothalamo-hypophyso-surrénalien).
L'utilisation de bêta-bloquants cardiosélectifs peut être envisagée pour traiter les effets bêta-2-adrénergiques, mais uniquement sous la surveillance d'un médecin et avec une extrême prudence car l'administration de bêta-bloquants peut induire un bronchospasme. Dans les cas graves, les patients doivent être hospitalisés.
PHARMACODYNAMIE |
Connectez-vous pour accéder à ce contenu
PHARMACOCINÉTIQUE |
Connectez-vous pour accéder à ce contenu
SÉCURITÉ PRÉCLINIQUE |
Il n'a pas été mené d'études chez l'animal avec l'association d'indacatérol, de glycopyrronium et de furoate de mométasone. Les évaluations non cliniques de chaque monothérapie et des associations indacatérol/mométasone et indacatérol/glycopyrronium sont présentées ci-après.
Indacatérol
Chez le chien, les effets sur le système cardiovasculaire imputables aux propriétés bêta-2-agonistes de l'indacatérol ont été une tachycardie, des arythmies et des atteintes myocardiques. Une irritation légère de la cavité nasale et du larynx a été observée chez les rongeurs.
Les études de génotoxicité n'ont pas révélé de potentiel mutagène ou clastogène.
La carcinogénicité a été évaluée dans une étude de deux ans chez le rat et dans une étude de six mois chez une souris transgénique. Les incidences accrues de léiomyomes ovariens bénins et d'hyperplasie focale du muscle lisse de l'ovaire chez la femelle rate concordent avec les observations similaires rapportées pour d'autres agonistes bêta-2 adrénergiques. Aucun signe de carcinogénicité n'a été observé chez la souris.
Tous ces effets sont survenus avec des expositions largement supérieures à celles attendues chez l'homme.
Après administration sous-cutanée dans une étude chez le lapin, les effets indésirables de l'indacatérol sur la grossesse et le développement embryo-fœtal n'ont été observés qu'à des doses plus de 500 fois supérieures à celles obtenues après l'inhalation quotidienne de 150 mcg chez l'homme (sur la base de l'ASC0-24 h).
Bien que l'indacatérol n'ait pas affecté les fonctions de reproduction générales dans une étude de fertilité chez le rat, une diminution du nombre de femelles rat gravides à la génération F1 a été observée lors d'une étude du développement péri- et post-natal chez le rat à une exposition 14 fois plus élevée que celle observée chez l'homme lors du traitement par l'indacatérol. L'indacatérol n'a pas été embryotoxique ou tératogène chez le rat ou le lapin.
Glycopyrronium
Les effets imputables aux propriétés antagonistes des récepteurs muscariniques du glycopyrronium ont été des augmentations légères à modérées de la fréquence cardiaque chez le chien, une opacification du cristallin chez le rat et des modifications réversibles associées à la diminution des sécrétions glandulaires chez le rat et le chien. Une irritation légère ou des modifications adaptatives de l'appareil respiratoire ont été observées chez le rat. Tous ces effets sont survenus à des expositions largement supérieures à celles attendues chez l'homme.
Les études de génotoxicité n'ont pas révélé de potentiel mutagène ou clastogène du glycopyrronium. Les études de cancérogenèse par voie orale chez des souris transgéniques et par voie inhalée chez des rats n'ont pas mis en évidence de potentiel cancérogène.
Après administration par voie inhalée, le glycopyrronium n'a pas été tératogène chez le rat ou le lapin. Il n'y a pas eu de transfert placentaire significatif du glycopyrronium ni de ses métabolites chez la souris, la lapine et la chienne gestantes. Les données publiées pour le glycopyrronium chez l'animal n'indiquent aucune toxicité sur la reproduction. La fertilité et les développements prénatal et postnatal n'ont pas été affectés chez le rat.
Furoate de mométasone
Tous les effets observés sont caractéristiques de la classe des glucocorticoïdes et correspondent à une exacerbation des effets pharmacologiques des glucocorticoïdes.
Le furoate de mométasone n'a pas montré d'activité génotoxique dans une batterie standard de tests in vitro et in vivo.
Dans les études de carcinogénicité chez la souris et le rat, il n'a pas été mis en évidence d'augmentation statistiquement significative de l'incidence des tumeurs avec le furoate de mométasone inhalé.
Comme les autres glucocorticoïdes, le furoate de mométasone est tératogène chez les rongeurs et les lapins. Les effets observés ont été l'apparition de hernies ombilicales chez le rat, de fentes palatines chez la souris et d'agénésies de la vésicule biliaire, de hernies ombilicales et de flexions des pattes avant chez les lapins. Il a également été observé une baisse de la prise de poids chez les mères, des effets sur la croissance fœtale (poids fœtal plus faible et/ou retard d'ossification) chez le rat, le lapin et la souris, ainsi qu'une diminution de la survie de la progéniture chez la souris. Dans les études sur la fonction de reproduction, l'injection sous-cutanée de furoate de mométasone, à la dose de 15 mcg/kg, a entrainé un allongement de la gestation ainsi que des difficultés de mise bas avec une réduction de la survie et du poids de la progéniture.
Évaluation du risque environnemental
Des études d'évaluation du risque environnemental ont montré que la mométasone peut présenter un risque pour les eaux de surface (voir rubrique Elimination/Manipulation).
Association de l'indacatérol et du glycopyrronium
Les observations issues des études de sécurité non clinique de l'indacatérol/glycopyrronium ont été cohérentes avec les effets pharmacologiques connus des composants indacatérol ou glycopyrronium administrés en monothérapie.
L'effet de l'association indacatérol/glycopyrronium sur la fréquence cardiaque a augmenté en intensité et en durée comparativement à celui observé avec chacun des composants administrés en monothérapie.
Une diminution des intervalles électrocardiographiques et une diminution de la pression artérielle systolique et diastolique ont également été observés. L'indacatérol administré seul à des chiens ou dans le cadre de l'association indacatérol/glycopyrronium a été associé à une incidence similaire des atteintes myocardiques.
Association de l'indacatérol et du furoate de mométasone
Les observations réalisées au cours des études de toxicité par voie inhalée de 13 semaines sont principalement attribuables au composant furoate de mométasone et elles correspondent aux effets pharmacologiques caractéristiques des glucocorticoïdes. Des augmentations de la fréquence cardiaque associées à l'indacatérol ont été observées chez le chien après l'administration d'indacatérol/furoate de mométasone ou d'indacatérol seul.
DURÉE DE CONSERVATION |
3 ans.
PRÉCAUTIONS PARTICULIÈRES DE CONSERVATION |
A conserver à une température ne dépassant pas 30 °C.
À conserver dans l'emballage d'origine à l'abri de la lumière et de l'humidité.
PRÉCAUTIONS PARTICULIÈRES D'ÉLIMINATION ET DE MANIPULATION |
Il convient d'utiliser l'inhalateur fourni à chaque nouvelle prescription. L'inhalateur inclus dans chaque boîte doit être éliminé lorsque toutes les gélules de cette boîte ont été utilisées.
Ce médicament peut présenter un risque pour l'environnement (voir rubrique Sécurité préclinique).
Tout médicament non utilisé ou déchet doit être éliminé conformément à la réglementation en vigueur.
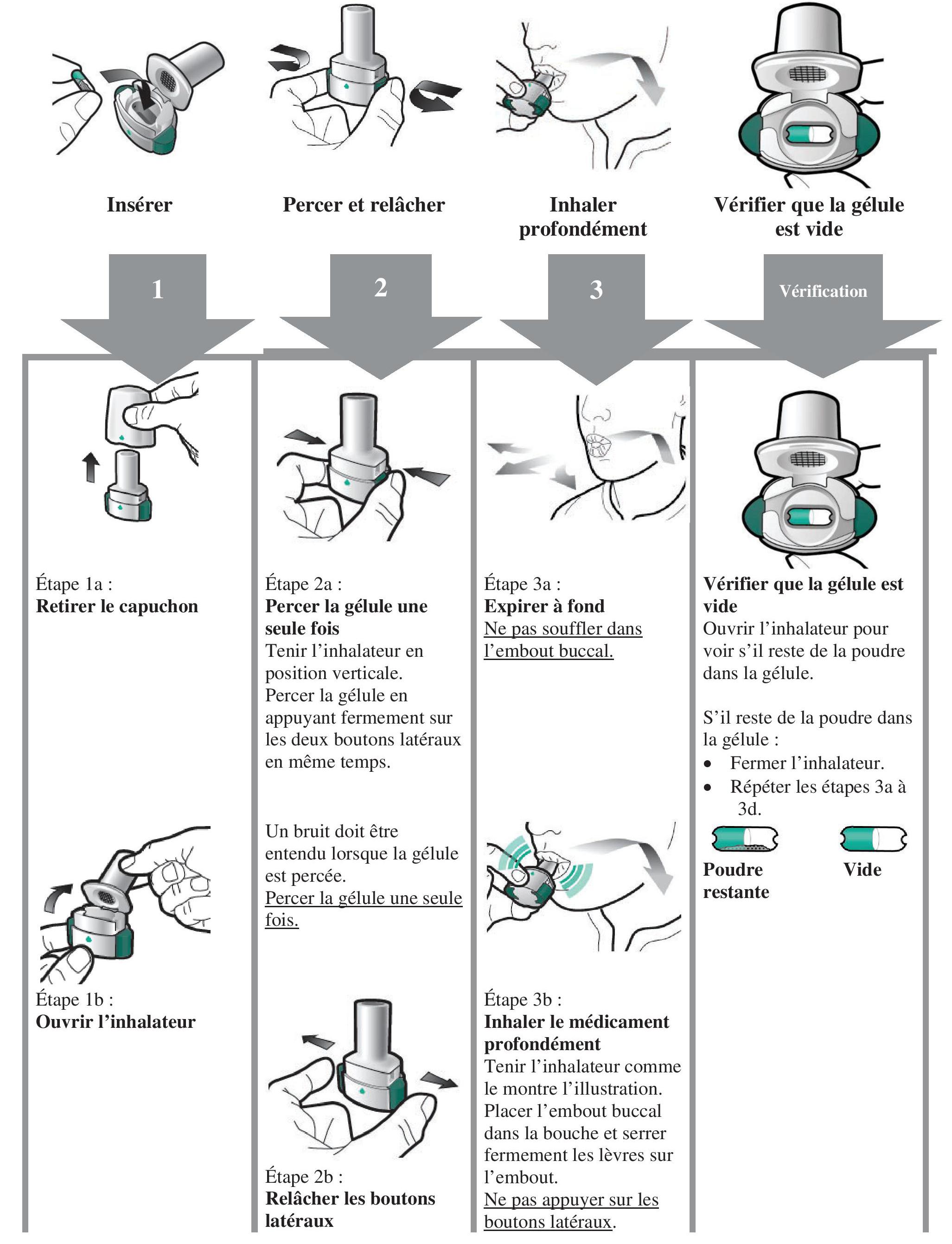
Instructions pour l'utilisation et la manipulation
Lire l'ensemble des instructions de manipulation avant d'utiliser Enerzair Breezhaler.


PRESCRIPTION/DÉLIVRANCE/PRISE EN CHARGE |
| AMM |
|
| Prix : |
|
Boîte de 30 gélules : Remb Séc soc à 30 %. Collect.
Boîte de 10 gélules : Collect.
L'inscription de la spécialité Enerzair Breezhaler sur la liste des spécialités remboursables aux assurés sociaux et sur la liste des médicaments agréés à l'usage des collectivités publiques est assortie d'une condition tenant à ce que la prescription initiale du médicament soit réalisée en concertation avec un médecin pneumologue.
Des informations détaillées sur ce médicament sont disponibles sur le site internet de l'Agence européenne des médicaments : https://www.ema.europa.eu.
Titulaire de l'AMM : Novartis Europharm Limited, Vista Building, Elm Park, Merrion Road, Dublin 4, Irlande.
 Document utile VIDAL
Document utile VIDAL