Veuillez saisir au moins 3 caractères pour votre recherche.
- Médicaments
- CAMCEVI
- CAMCEVI 42 mg susp inj LP
Sommaire
Cip : 3400930255681
Modalités de conservation : Avant ouverture : 2° < t < 8° durant 24 mois (Conserver à l'abri de la lumière, Conserver dans son emballage, Conserver au réfrigérateur)
FORMES et PRÉSENTATIONS |
Suspension injectable à libération prolongée (couleur blanc cassé à jaune pâle, visqueuse et opalescente).
Boîte contenant : 1 seringue préremplie munie d'un capuchon, d'un piston et d'ailettes + 1 aiguille de sécurité stérile (calibre 18 gauge, 5/8 pouce).
COMPOSITION |
Chaque seringue préremplie de suspension injectable à libération prolongée contient une quantité de mésylate de leuproréline équivalente à 42 mg de leuproréline.
Poly(D,L-lactide), N-méthyl-pyrrolidone.
INDICATIONS |
CAMCEVI est indiqué pour le traitement du cancer de la prostate hormono-dépendant à un stade avancé et en association avec la radiothérapie dans le traitement du cancer de la prostate localisé à haut risque et localement avancé hormono-dépendant.
POSOLOGIE ET MODE D'ADMINISTRATION |
Connectez-vous pour accéder à ce contenu
CONTRE-INDICATIONS |
Connectez-vous pour accéder à ce contenu
MISES EN GARDE et PRÉCAUTIONS D'EMPLOI |
Le traitement de suppression androgénique est susceptible d'allonger l'intervalle QT
Chez les patients ayant des antécédents ou des facteurs de risque d'allongement du QT et chez les patients recevant un traitement concomitant par des médicaments susceptibles d'allonger l'intervalle QT (voir rubrique Interactions), avant d'instaurer le traitement par leuproréline, le médecin doit évaluer le rapport bénéfice-risque, notamment la possibilité de survenue de Torsades de pointe. Une surveillance périodique des électrocardiogrammes et des taux d'électrolytes doit être envisagée.
Maladies cardiovasculaires
Un risque accru de développer un infarctus du myocarde, de mort cardiaque subite et d'accident vasculaire cérébral a été rapporté en association à l'utilisation des agonistes de la GnRH chez les hommes. Ce risque semble être faible sur la base des odds ratios rapportés, et il doit être soigneusement évalué avec les facteurs de risque cardiovasculaires au moment de la détermination d'un traitement pour les patients atteints d'un cancer de la prostate. Les patients recevant des agonistes de la GnRH doivent faire l'objet d'une surveillance visant à déceler les symptômes et signes suggérant l'apparition d'une maladie cardiovasculaire et être pris en charge conformément à la pratique clinique en vigueur.
Augmentation transitoire du taux de testostérone
La leuproréline, comme les autres agonistes de la GnRH, entraîne une augmentation transitoire des concentrations sériques de testostérone, de dihydrotestostérone et de phosphatase acide pendant la première semaine de traitement. Les patients peuvent présenter une aggravation de leurs symptômes ou l'apparition de nouveaux symptômes, notamment des douleurs osseuses, une neuropathie, une hématurie, ou une obstruction urétérale ou vésicale (voir rubrique Effets indésirables). Ces symptômes régressent généralement au cours du traitement.
L'administration supplémentaire d'un anti-androgène approprié doit être envisagée 3 jours avant l'instauration du traitement par leuproréline et poursuivie pendant les deux à trois premières semaines du traitement. Ce traitement s'est révélé prévenir les séquelles d'une augmentation initiale de la testostéronémie.
Suite à une castration chirurgicale, la leuproréline n'entraîne pas de diminution supplémentaire des taux sériques de testostérone chez les hommes.
Densité osseuse
Une diminution de la densité osseuse a été rapportée dans la littérature médicale chez des hommes ayant subi une orchidectomie ou ayant été traités par des agonistes de la GnRH (voir rubrique Effets indésirables).
Le traitement par anti-androgène augmente significativement le risque de fractures liées à l'ostéoporose. Les données disponibles à ce sujet sont limitées. Des fractures liées à l'ostéoporose ont été constatées chez 5 % des patients après 22 mois d'un traitement de suppression androgénique pharmacologique et chez 4 % des patients après 5 à 10 ans de traitement. Le risque de fractures liées à l'ostéoporose est généralement plus élevé que le risque de fractures pathologiques.
En plus du déficit prolongé en testostérone, le vieillissement, le tabagisme et la consommation de boissons alcoolisées, l'obésité et le manque d'exercice physique sont susceptibles d'avoir une influence sur l'apparition de l'ostéoporose.
Apoplexie pituitaire
Au cours de la surveillance post-commercialisation, de rares cas d'apoplexie pituitaire (un syndrome clinique secondaire à un infarctus de la glande pituitaire) ont été rapportés après l'administration d'agonistes de la GnRH, la majorité de ces cas survenant dans les 2 semaines suivant l'administration de la première dose, et certains dans la première heure suivant l'administration. Dans ces cas, l'apoplexie pituitaire s'est manifestée par des céphalées soudaines, des vomissements, des troubles visuels, une ophtalmoplégie, une altération de l'état mental, et parfois un collapsus cardiovasculaire. Ces cas nécessitent une attention médicale immédiate.
Modifications métaboliques
Une hyperglycémie et un risque accru d'apparition d'un diabète ont été rapportés chez des hommes recevant des agonistes de la GnRH. L'hyperglycémie est susceptible d'être liée à l'apparition d'un diabète sucré ou à la dégradation du contrôle glycémique chez les patients diabétiques. La glycémie et/ou le taux d'hémoglobine glycosylée (HbA1c) doivent être surveillés périodiquement chez les patients recevant un agoniste de la GnRH, et ces derniers doivent être pris en charge en suivant les pratiques en vigueur en ce qui concerne le traitement de l'hyperglycémie ou du diabète. Les modifications métaboliques liées aux agonistes de la GnRH peuvent également inclure la stéatose hépatique.
Convulsions
Des cas de convulsions ont été rapportés après la commercialisation du produit chez des patients sous leuproréline avec ou sans antécédents de facteurs prédisposants (voir rubrique Effets indésirables). Les convulsions doivent être prises en charge conformément à la pratique clinique en vigueur.
Hypertension intracrânienne idiopathique
Des cas d'hypertension intracrânienne idiopathique (pseudo-tumeur cérébrale) ont été rapportés chez des patients recevant de la leuproréline. Les patients doivent être avertis de la possibilité de signes et symptômes d'hypertension intracrânienne idiopathique, notamment des céphalées sévères ou récurrentes, de troubles visuels et d'acouphènes. En présence d'une hypertension intracrânienne idiopathique, l'interruption du traitement par leuproréline doit être envisagée.
Réactions indésirables cutanées sévères
Des réactions indésirables cutanées sévères (SCAR), dont le syndrome de Stevens-Johnson (SSJ), et la nécrolyse épidermique toxique (NET, ou syndrome de Lyell), qui peuvent engager le pronostic vital ou être fatals, ont été rapportés en association avec le traitement par leuproréline. Au moment de la prescription, les patients doivent être informés des signes et symptômes et surveillés étroitement en cas de réactions cutanées graves. En cas d'apparition de signes et symptômes évocateurs de ces réactions, le traitement par leuproréline doit être arrêté immédiatement et un autre traitement doit être envisagé (le cas échéant).
Autres événements
Des cas d'obstruction urétérale et de compression de la moelle épinière, susceptible de contribuer à une paralysie, avec ou sans complications fatales, ont été rapportés avec les agonistes de la GnRH. En cas d'apparition d'une compression de la moelle épinière ou d'une insuffisance rénale, un traitement standard de ces complications doit être instauré.
Les patients présentant des métastases vertébrales et/ou cérébrales, ainsi que les patients présentant une obstruction des voies urinaires doivent faire l'objet d'une surveillance attentive pendant les premières semaines de traitement.
INTERACTIONS |
Connectez-vous pour accéder à ce contenu
FERTILITÉ/GROSSESSE/ALLAITEMENT |
CAMCEVI est contre-indiqué chez les femmes.
Les résultats des études menées chez l'animal et le mécanisme d'action permettent de conclure que la leuproréline est susceptible de réduire la fertilité chez les hommes en âge de procréer (voir rubrique Sécurité préclinique).
CONDUITE et UTILISATION DE MACHINES |
Les médicaments à base de leuproréline ont une influence mineure sur l'aptitude à conduire un véhicule et à utiliser des machines. L'administration de ce médicament peut occasionner de la fatigue, des étourdissements et des troubles visuels (voir rubrique Effets indésirables). Il doit être conseillé aux patients de s'abstenir de conduire un véhicule ou d'utiliser des machines s'ils ressentent ces effets indésirables.
EFFETS INDÉSIRABLES |
Connectez-vous pour accéder à ce contenu
SURDOSAGE |
La leuproréline ne présente aucun potentiel d'abus et un surdosage délibéré est peu probable.
Aucun cas d'abus ou de surdosage n'a été rapporté en pratique clinique avec la leuproréline ; en cas de surdosage, il est recommandé de mettre le patient en observation et d'administrer un traitement de soutien symptomatique.
PHARMACODYNAMIE |
Connectez-vous pour accéder à ce contenu
PHARMACOCINÉTIQUE |
Connectez-vous pour accéder à ce contenu
SÉCURITÉ PRÉCLINIQUE |
Les études précliniques avec la leuproréline ont révélé des effets sur les organes de reproduction des deux sexes, auxquels on pouvait s'attendre d'après les propriétés pharmacologiques connues. Ces effets se sont avérés réversibles après l'arrêt du traitement et une période appropriée de rétablissement. La leuproréline n'a pas présenté de tératogénicité. Une embryotoxicité/létalité a été observée chez le lapin, ce qui correspond aux effets pharmacologiques de la leuproréline sur les organes de reproduction.
Une hyperplasie et un adénome ont été observés dans la partie antérieure de la glande pituitaire de rats, ce qui correspond aux effets de la leuproréline en tant qu'agoniste de la GnRH.
Des études de cancérogenèse sur 24 mois ont été effectuées chez des rats et des souris. Chez le rat, une augmentation liée à la dose de l'apoplexie pituitaire a été constatée après administration sous-cutanée de doses de 0,6 à 4 mg/kg/jour. Cet effet n'a pas été observé chez la souris.
La leuproréline n'a pas été mutagène dans une série d'expériences in-vitro et in-vivo.
DURÉE DE CONSERVATION |
2 ans.
PRÉCAUTIONS PARTICULIÈRES DE CONSERVATION |
À conserver au réfrigérateur (entre 2 °C et 8 °C).
Conserver dans l'emballage extérieur d'origine à l'abri de la lumière.
PRÉCAUTIONS PARTICULIÈRES D'ÉLIMINATION ET DE MANIPULATION |
Veuillez suivre les instructions indiquées afin de garantir une préparation correcte de CAMCEVI avant l'administration.
Important : Laisser CAMCEVI atteindre la température ambiante (15 °C à 25 °C) avant utilisation. Il est recommandé d'utiliser des gants pendant l'administration.
CAMCEVI contient :
Seringue préremplie assemblée :
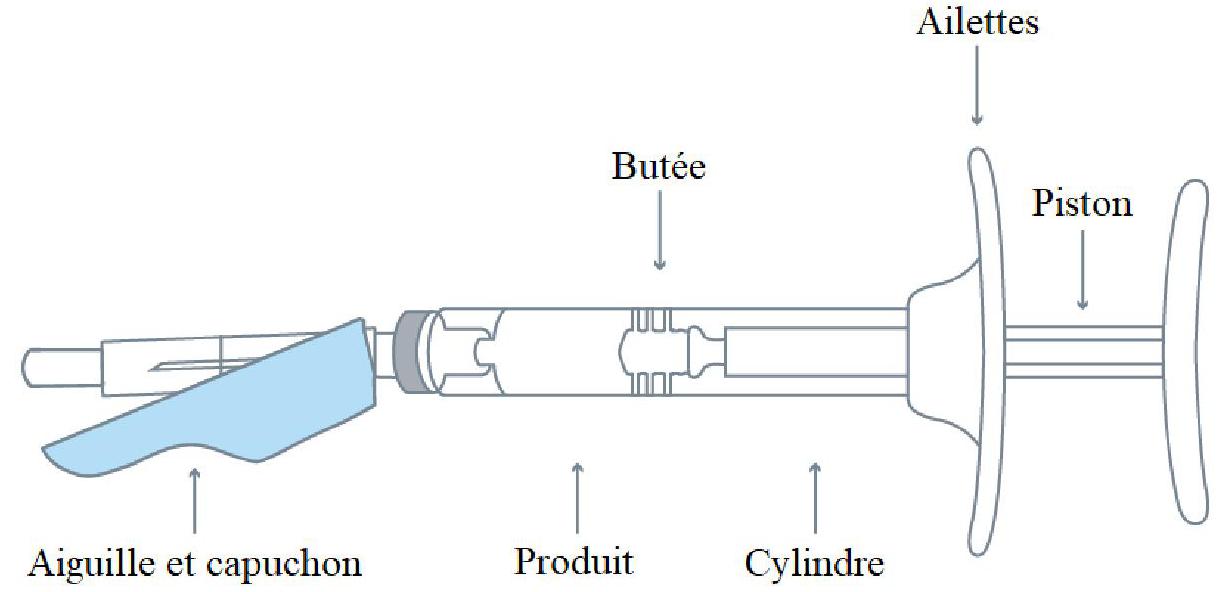
|
Laisser le produit atteindre la température ambiante et examiner le contenu
|
Fixer l'aiguille
|
|
Préparer le site d'injection
|
|
|
Administrer le traitement
|
L'injection intra-artérielle ou intraveineuse doit être strictement évitée. |
Protection de l'aiguille
|
Tout médicament non utilisé ou déchet doit être éliminé conformément à la réglementation en vigueur. |
PRESCRIPTION/DÉLIVRANCE/PRISE EN CHARGE |
| AMM |
|
| Prix : |
|