Veuillez saisir au moins 3 caractères pour votre recherche.
- Médicaments
- ADZYNMA
- ADZYNMA 1500 UI pdre/solv p sol inj
Sommaire
EEN sans dose seuil : polysorbate 80
EEN sans dose seuil : polysorbate 80
Cip : 3400930297803
Modalités de conservation : Avant ouverture : 2° < t < 8° durant 36 mois (Conserver à l'abri de la lumière, Conserver au réfrigérateur, Conserver dans son emballage, Ne pas congeler)
| FORMES et PRÉSENTATIONS |
ADZYNMA 500 UI poudre et solvant pour solution injectable
Poudre (lyophilisée, blanche) et solvant (solution limpide et incolore) pour solution injectable.
La solution reconstituée a un pH de 6,7-7,3 et une osmolalité qui est d'au moins 240 mOsmol/kg.
Chaque boîte contient :
ADZYNMA 1 500 UI poudre et solvant pour solution injectable
Poudre (lyophilisée, blanche) et solvant (solution limpide et incolore) pour solution injectable.
La solution reconstituée a un pH de 6,7-7,3 et une osmolalité qui est d'au moins 240 mOsmol/kg.
Chaque boîte contient :
| COMPOSITION |
ADZYNMA 500 UI poudre et solvant pour solution injectable
Chaque flacon de poudre contient nominalement 500 unités internationales (UI) d'activité d'ADAMTS13r*, mesuré en termes de puissance.
Après reconstitution avec les 5 mL de solvant fournis, la solution a une activité d'environ 100 UI/mL.
ADZYNMA 1 500 UI poudre et solvant pour solution injectable
Chaque flacon de poudre contient nominalement 1 500 UI d'activité d'ADAMTS13r*, mesuré en termes de puissance.
Après reconstitution avec les 5 mL de solvant fournis, la solution a une activité d'environ 300 UI/mL.
* ADZYNMA est une protéine recombinante humaine bivariant purifiée « Une désintégrine et une métalloprotéinase avec des motifs de thrombospondine 13 » (ADAMTS13r) exprimée dans des cellules d'Ovaire de Hamster Chinois (CHO) à l'aide de la technologie de l'ADN recombinant (un mélange de ADAMTS13r Q23 natif et de variant ADAMTS13r R23 avec une gamme contrôlée de rapport à deux variantes), appelée ADAMTS13r.
Poudre : chlorure de sodium, chlorure de calcium dihydraté, L-histidine, mannitol, sucrose, polysorbate 80 (E433).
Solvant : eau pour préparations injectables.
| INDICATIONS |
ADZYNMA est indiqué dans le traitement enzymatique substitutif (TES) chez les patients adultes et enfants atteints de purpura thrombotique thrombocytopénique congénital (PTTc) dû à un déficit en ADAMTS13.
ADZYNMA peut être utilisé dans toutes les tranches d'âge.
| POSOLOGIE ET MODE D'ADMINISTRATION |
Connectez-vous pour accéder à ce contenu
| CONTRE-INDICATIONS |
Connectez-vous pour accéder à ce contenu
| MISES EN GARDE et PRÉCAUTIONS D'EMPLOI |
Traçabilité
Afin d'améliorer la traçabilité des médicaments biologiques, le nom et le numéro de lot du produit administré doivent être clairement enregistrés.
Réactions d'hypersensibilité
Une hypersensibilité de type allergique, incluant des réactions anaphylactiques, peut survenir. Les patients doivent être informés des signes précoces de réactions d'hypersensibilité, notamment tachycardie, oppression thoracique, respiration sifflante et/ou détresse respiratoire aiguë, hypotension, urticaire généralisée, prurit, rhino-conjonctivite, œdème de Quincke, léthargie, nausées, vomissements, paresthésie, agitation, qui peuvent évoluer vers un choc anaphylactique. En cas de signes et symptômes de réactions allergiques graves, l'administration de ce médicament doit être immédiatement interrompue et des soins de support appropriés doivent être prodigués au patient.
Immunogénicité
Comme pour toutes les protéines thérapeutiques, il existe un risque d'immunogénicité. Les patients peuvent développer des anticorps dirigés contre l'ADAMTS13r après un traitement par ADZYNMA, ce qui pourrait entraîner une diminution de la réponse à l'ADAMTS13r (voir rubrique Pharmacodynamie). Si la présence de tels anticorps est soupçonnée et qu'un manque d'efficacité est constaté, il convient d'envisager d'autres stratégies thérapeutiques.
Teneur en sodium
Ce médicament contient moins de 1 mmol (23 mg) de sodium par mL, c.-à-d. qu'il est essentiellement « sans sodium ».
| INTERACTIONS |
Connectez-vous pour accéder à ce contenu
| FERTILITÉ/GROSSESSE/ALLAITEMENT |
Grossesse
Il n'existe pas de données ou il existe des données limitées sur l'utilisation d'ADZYNMA chez la femme enceinte. Les études effectuées chez l'animal n'ont pas mis en évidence d'effets délétères directs ou indirects sur la reproduction (voir rubrique Sécurité préclinique). L'utilisation d'ADZYNMA pendant la grossesse ne peut être envisagée qu'après une analyse individuelle approfondie des risques et des bénéfices par le médecin prescripteur avant et pendant le traitement.
Allaitement
Il n'existe pas de données suffisantes sur l'excrétion de l'ADAMTS13r dans le lait maternel ou animal, mais au vu de son poids moléculaire élevé, il est peu probable qu'elle soit excrétée dans le lait maternel. La décision d'interrompre l'allaitement ou d'arrêter ADZYNMA doit s'appuyer sur l'importance du médicament pour la mère.
Fertilité
On ne dispose d'aucune donnée humaine sur les effets de l'ADAMTS13r sur la fertilité masculine et féminine. Les données animales n'indiquent pas d'effets délétères directs ou indirects sur la fertilité des mâles et des femelles (voir rubrique Sécurité préclinique).
| CONDUITE et UTILISATION DE MACHINES |
L'ADAMTS13r peut avoir une influence mineure sur l'aptitude à conduire des véhicules et à utiliser des machines. Une sensation vertigineuse et une somnolence peuvent survenir suite à l'administration d'ADZYNMA (voir rubrique Effets indésirables).
| EFFETS INDÉSIRABLES |
Connectez-vous pour accéder à ce contenu
| SURDOSAGE |
Dans les études cliniques, des doses uniques allant jusqu'à 160 UI/kg ont été utilisées, et leur profil de sécurité était généralement cohérent avec les résultats des études cliniques chez les patients atteints de PTTc.
En cas de surdosage, compte tenu de l'action pharmacologique de l'ADAMTS13r, il existe un risque potentiel accru de saignement (voir rubrique Pharmacodynamie).
| PHARMACODYNAMIE |
Connectez-vous pour accéder à ce contenu
| PHARMACOCINÉTIQUE |
Connectez-vous pour accéder à ce contenu
| SÉCURITÉ PRÉCLINIQUE |
Les données non cliniques issues des études de pharmacologie de sécurité, toxicologie en administration unique, toxicité sur les fonctions de reproduction et de développement, tolérance locale et immunogénicité, n'ont pas révélé de risque particulier pour l'Homme. Aucune étude n'a été menée avec l'ADAMTS13r pour évaluer son potentiel mutagène ou cancérigène.
| INCOMPATIBILITÉS |
En l'absence d'études de compatibilité, ce médicament ne doit pas être mélangé avec d'autres médicaments.
| DURÉE DE CONSERVATION |
Flacon non ouvert
3 ans
Après reconstitution
La stabilité physico-chimique en cours d'utilisation a été démontrée pendant 6 heures à 25 °C.
D'un point de vue microbiologique, le médicament doit être utilisé immédiatement, sauf si la méthode d'ouverture/de reconstitution/de dilution prévient tout risque de contamination microbienne. S'il n'est pas utilisé immédiatement, les durées et conditions de conservation en cours d'utilisation relèvent de la responsabilité de l'utilisateur.
| PRÉCAUTIONS PARTICULIÈRES DE CONSERVATION |
Poudre
À conserver au réfrigérateur (entre 2 °C et 8 °C).
Ne pas congeler.
À conserver dans l'emballage d'origine, à l'abri de la lumière.
ADZYNMA peut être conservé à température ambiante jusqu'à 30 °C pendant une période allant jusqu'à 6 mois sous forme lyophilisée, mais sans dépasser la date de péremption.
Ne pas remettre ADZYNMA au réfrigérateur après l'avoir conservé à température ambiante.
Noter sur l'emballage la date à laquelle ADZYNMA a été sorti du réfrigérateur.
Après reconstitution
Pour les conditions de conservation du médicament après reconstitution, voir la rubrique Durée de conservation.
| PRÉCAUTIONS PARTICULIÈRES D'ÉLIMINATION ET DE MANIPULATION |
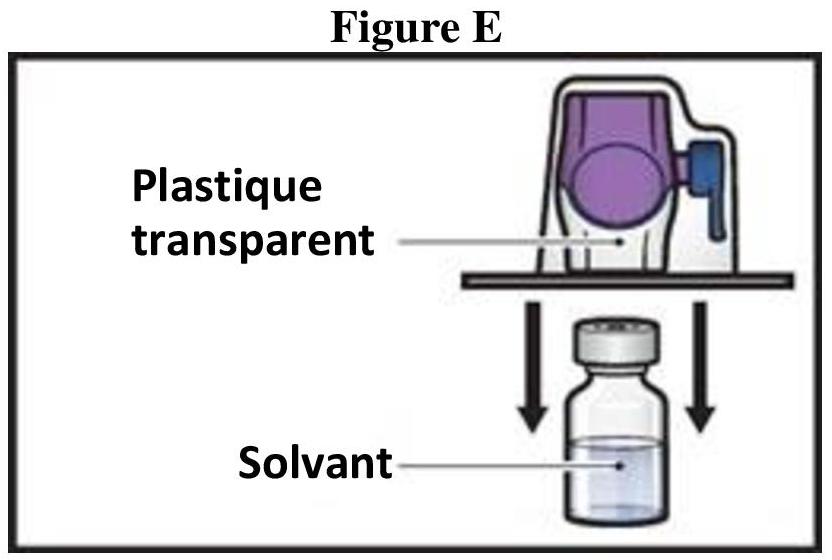
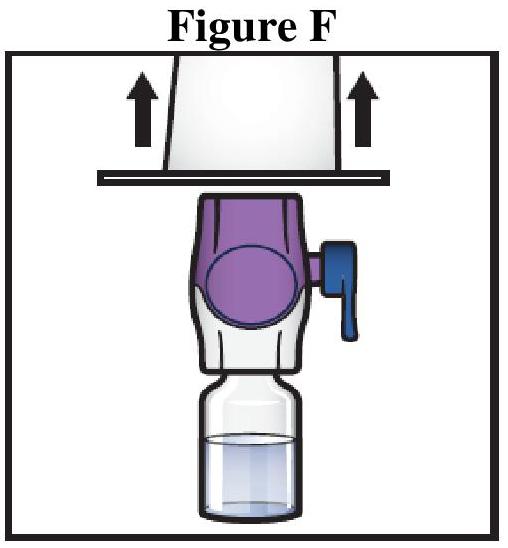
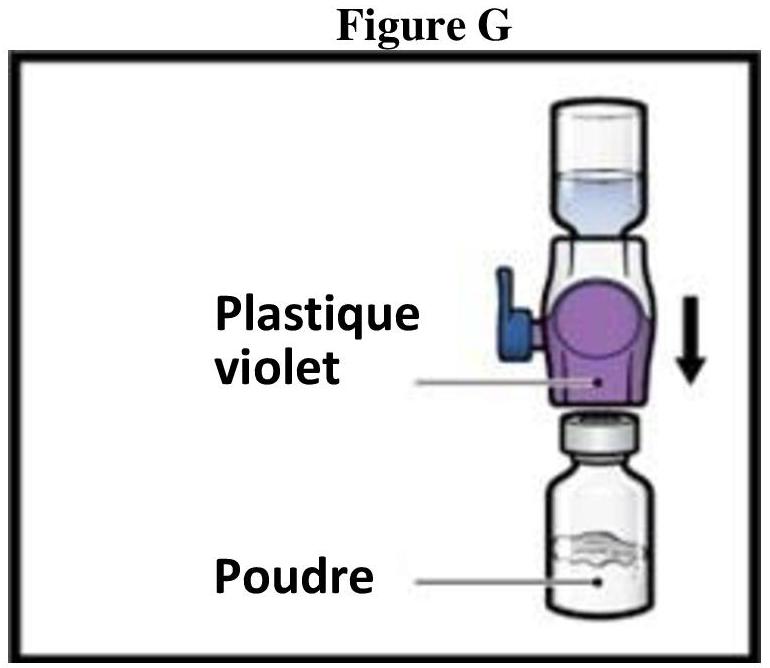
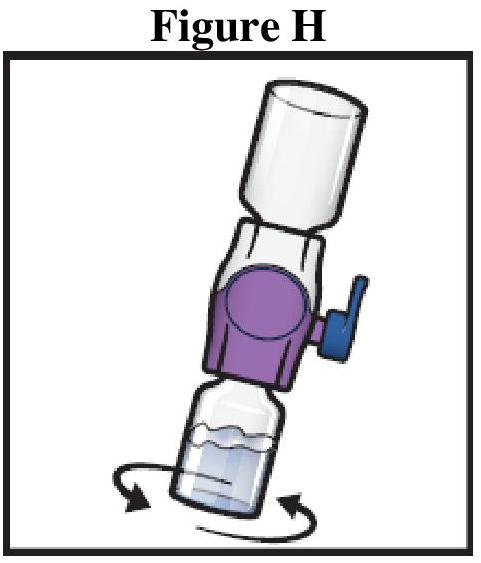
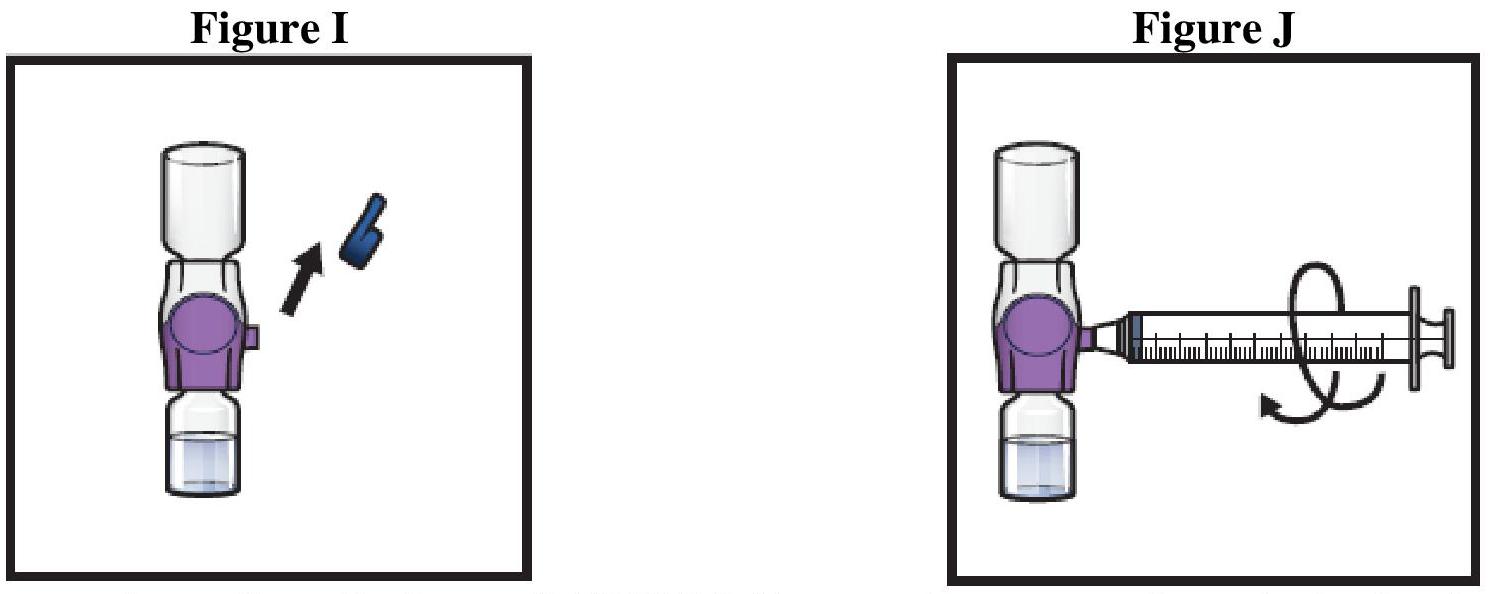
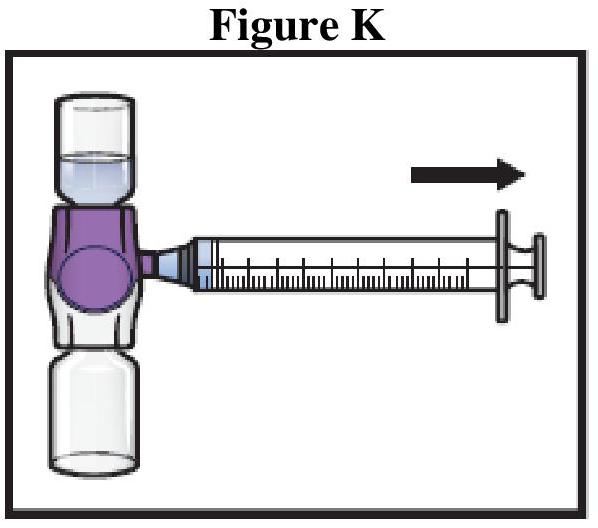
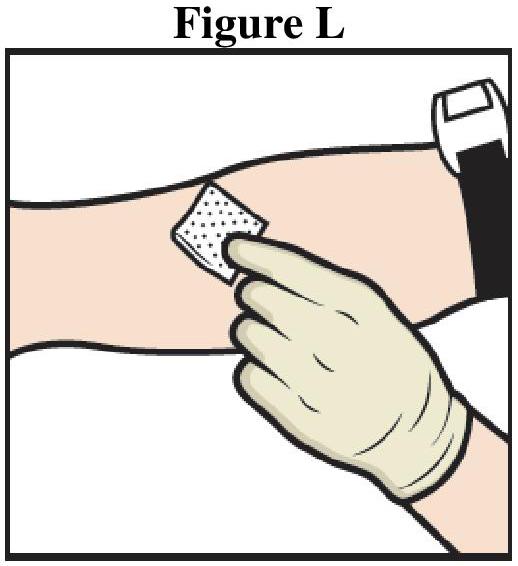
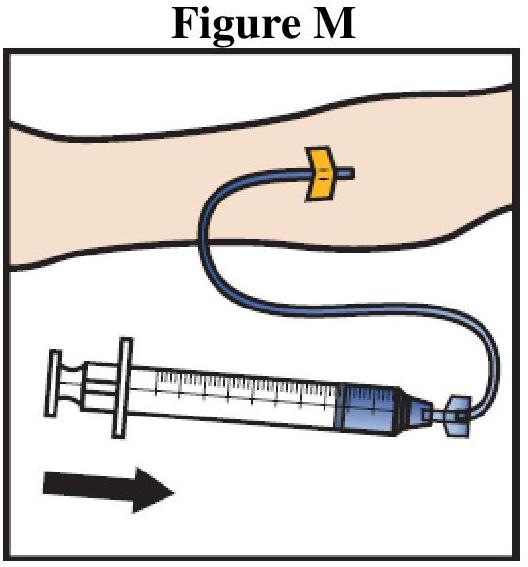
ADZYNMA doit être administré par voie intraveineuse après reconstitution de la poudre avec l'eau pour préparations injectables fournie.
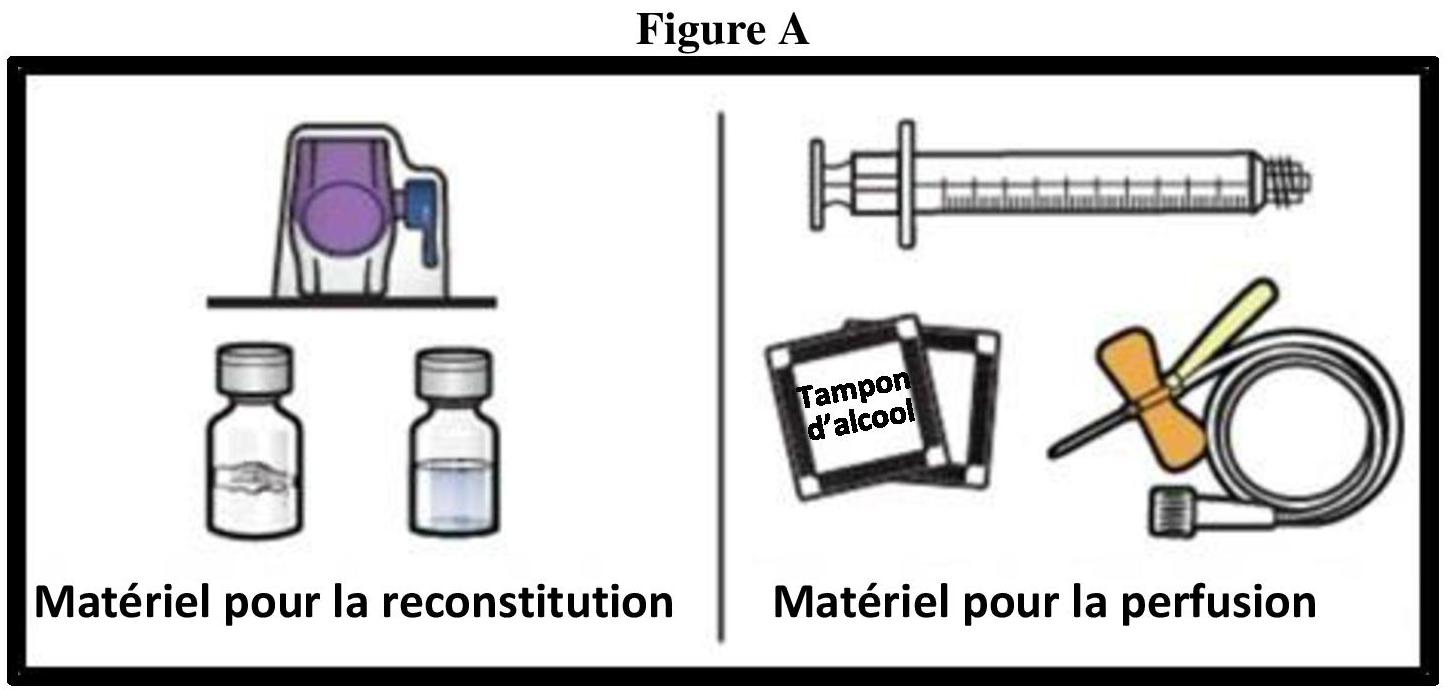
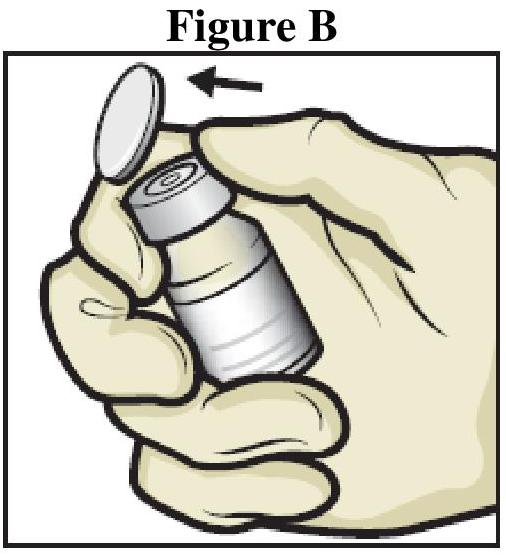
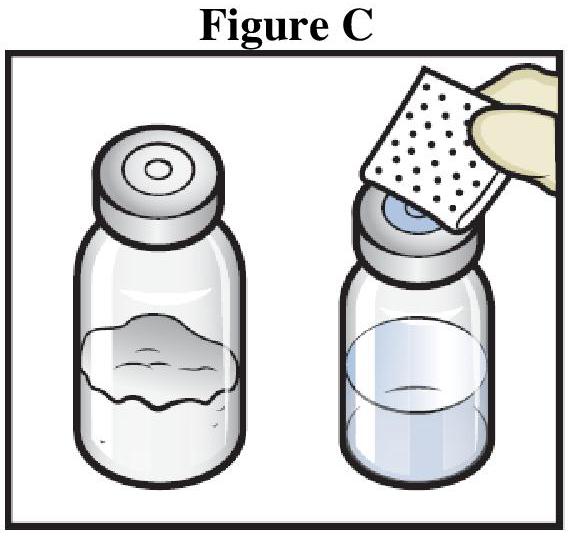
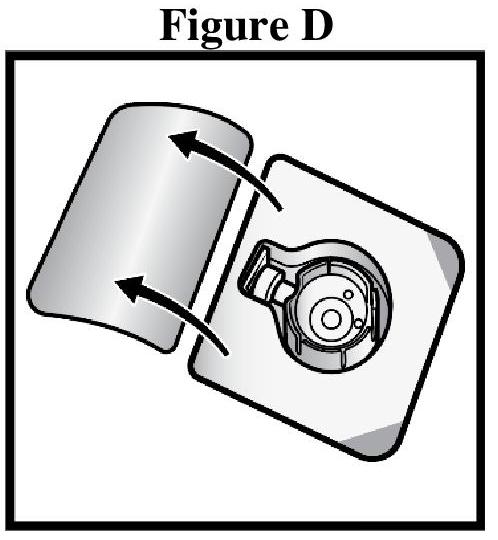
Instructions générales
Reconstitution
 |
 |
 |
 |
 |
 |
 |
 |
 |
 |
 |
 |
Tout médicament non utilisé ou déchet doit être éliminé conformément à la réglementation locale en vigueur.
| PRESCRIPTION/DÉLIVRANCE/PRISE EN CHARGE |
| AMM |
|
| Prix : |
|
Remb. Séc soc à 65%, Collect et inscrit sur la liste des spécialités prises en charge en sus des GHS.
Prix et tarif de responsabilité (HT) par UCD :
UCD 3400890041355 (flacon) : 4500,000 euros.
| AMM |
|
| Prix : |
|
Remb. Séc soc à 65%, Collect et inscrit sur la liste des spécialités prises en charge en sus des GHS.
Prix et tarif de responsabilité (HT) par UCD :
UCD 3400890041362 (flacon) : 1500,000 euros.