Grâce à VIDAL, restez informé des dernières actualités santé du secteur médical.
Toutes les actualités VIDAL.fr-
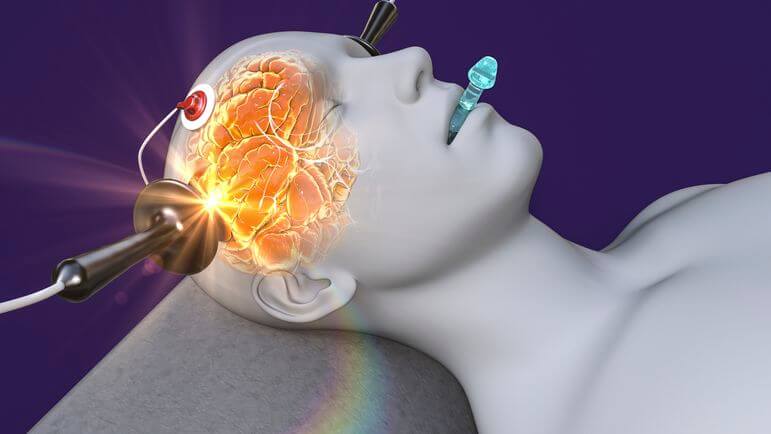 23 avril 2024
23 avril 2024Électroconvulsivothérapie, un traitement de choc !
L’électroconvulsivothérapie (ECT) consiste à délivrer un stimulus électrique à travers le cerveau afin de provoquer une brève crise convulsive contrôlée dans sa forme, son intensité, et sa durée. La séance d’ECT est réalisée au...
#Santé -
 11 avril 2024
11 avril 2024Allergie aux protéines de lait de vache : attention aux surdiagnostics
Dans un contexte global d’augmentation des allergies, notamment alimentaires, l’allergie aux protéines de lait de vache (APLV) serait cependant surdiagnostiquée, ce qui conduit à une prescription en excès de substituts de lait de vache et...
#Santé publique #Grossesse et allaitement -
 09 avril 2024
09 avril 2024La prescription chez une femme enceinte ou susceptible de l’être
La prise de médicaments lors de la grossesse est parfois nécessaire, ponctuellement, par exemple en cas d’infection, ou lors d’une maladie chronique, comme un asthme. Le bénéfice attendu du ou des médicaments concerne la mère, mais...
#Médicaments #Vigilance





