-
.jpg) 23 avril 2024#Médicaments #Prescription - Délivrance
23 avril 2024#Médicaments #Prescription - Délivrance -
 23 avril 2024
23 avril 2024KEPPRA solution buvable : conduite à tenir si la graduation de la seringue est illisible
#Médicaments #Alertes - Lots -
.jpg)
-
.jpg)
-
 23 avril 2024
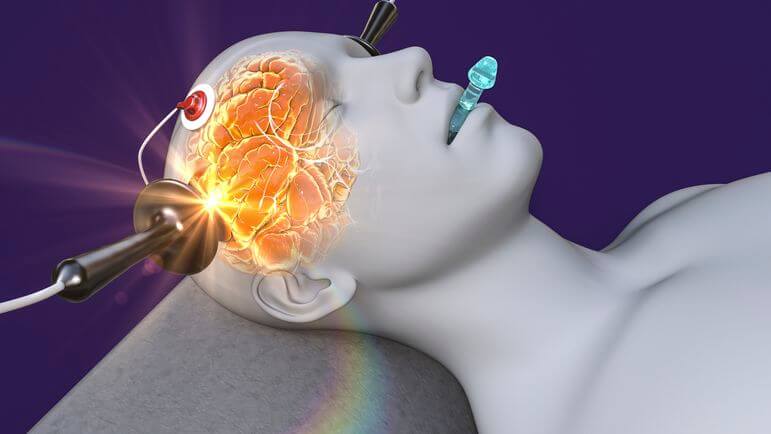
23 avril 2024Électroconvulsivothérapie, un traitement de choc !
L’électroconvulsivothérapie (ECT) consiste à délivrer un stimulus électrique à travers le cerveau afin de provoquer une brève crise convulsive contrôlée dans sa forme, son intensité, et sa durée. La séance d’ECT est réalisée au...
#Santé -
.jpg) 22 avril 2024
22 avril 2024Première formulation per os de néfopam en France
NEFOPAM PANPHARMA 30 mg comprimé pelliculé est une nouvelle spécialité commercialisée en France, en alternative au néfopam en solution injectable. Comme la forme injectable, NEFOPAM PANPHARMA 30 mg comprimé pelliculé est indiqué...
#Médicaments #Nouvelle spécialité -
 19 avril 2024
19 avril 2024ERLEADA : nouveau dosage à 240 mg pour une prise quotidienne unique
#Médicaments #Dosage -
.jpg) 11 avril 2024
11 avril 2024TRAMADOL : des conditionnements plus petits en réponse au mésusage
#Médicaments #Bon usage -
.jpg)
-
 11 avril 2024
11 avril 2024AMVUTTRA : un nouveau médicament pour l'amylose héréditaire à transthyrétine
AMVUTTRA 25 mg solution injectable est un nouveau médicament indiqué dans le traitement de l’amylose héréditaire à transthyrétine (amylose hATTR), chez les patients adultes atteints de polyneuropathie. Il contient un nouveau...
#Médicaments #Nouvelle spécialité -
 11 avril 2024
11 avril 2024Anémie associée à l'insuffisance rénale : prise en charge de MIRCERA étendue chez l'enfant
Dans le traitement de l'anémie symptomatique associée à l'insuffisance rénale chronique, l'anti-anémique MIRCERA solution injectable en seringue préremplie (méthoxy polyéthylène glycol-époétine bêta) est désormais remboursable (65...
#Médicaments #Prise en charge -
 11 avril 2024
11 avril 2024XEMBIFY : une immunoglobuline humaine SC supplémentaire sur le marché français
#Médicaments #Nouvelle spécialité -
 11 avril 2024
11 avril 2024Complément de gamme : STELARA 45 mg et 90 mg disponibles en stylo prérempli
#Médicaments #Présentation -
 11 avril 2024
11 avril 2024Allergie aux protéines de lait de vache : attention aux surdiagnostics
Dans un contexte global d’augmentation des allergies, notamment alimentaires, l’allergie aux protéines de lait de vache (APLV) serait cependant surdiagnostiquée, ce qui conduit à une prescription en excès de substituts de lait de vache et...
#Santé publique #Grossesse et allaitement -
 09 avril 2024
09 avril 2024Pas de pseudoéphédrine pour un rhume : l'ANSM alerte à nouveau les professionnels de santé
#Médicaments #Vigilance
Veuillez saisir au moins 3 caractères pour votre recherche.




