
CRISPR-Cas9, un outil de modification ciblée du génome extrêmement précis (illustration)
Depuis sa création en 1901 et jusqu'en 2019, neuf lauréats français avaient reçu le prix Nobel de chimie.
Le premier lauréat, bien oublié, fut Henri Moissan, en 1906, pour la découverte de l'élément « fluor », et « l'adoption au service de la science du four électrique » (NDLR : le four de Moissan était un four permettant d'obtenir à de très hautes températures [jusqu'à 3 500 °C] des oxydes, métaux, carbures, ce qui a ouvert de nombreux champs industriels).
En 1911, c'est au tour de Marie Curie de recevoir le prix pour sa découverte du radium et du polonium. Pour Marie Curie, cette nouvelle nomination a fait suite au prix Nobel de physique reçu en 1903 avec Pierre Curie, son mari, et Henri Becquerel, pour leurs travaux sur la radioactivité.
En 1912, Victor Grignard a reçu cette récompense pour « l'invention des réactifs organomagnésiens » qui porte son nom (NDLR : composés organiques présentant une liaison carbone-magnésium dont la connaissance est à la base de la chimie organométallique), ainsi que Paul Sabatier pour sa « méthode d'hydrogénation des composés organiques ».
En 1935, le prix Nobel a été attribué à Frédéric et Irène Joliot-Curie, en reconnaissance de leur « synthèse de nouveaux éléments radioactifs ».
En 1987, c'est Jean-Marie Lehn qui a été nobélisé, en compagnie de deux Américains (Donald J. Cram et Charles Pedersen) pour « l'élaboration de molécules exerçant, du fait de leurs structures, des interactions hautement sélectives ».
Au XXIe siècle, la France a aussi reçu deux fois le prix Nobel de chimie. En 2005, Yves Chauvin et deux Américains, Robert Grubbs et Richard R. Schrock ont été choisis pour leurs travaux sur « la méthode de la métathèse des alcènes en synthèse organique » (NDLR : réaction au cours de laquelle des fragments de molécules organiques s'intervertissent) ; en 2016, Jean-Pierre Sauvage, l'Anglais James Fraser Stoddart et le Néerlandais Bernard L. Feringa pour « la conception et la synthèse de machines moléculaires », encore appelées nanomachines.
Des ciseaux moléculaires pour couper l'ADN
C'est donc avec une grande fierté qu'a été accueillie la nomination au prix Nobel de chimie 2020 d'Emmanuelle Charpentier et de sa collègue américaine Jennifer Doudna pour avoir mis au point « la technique d'édition génomique CRISPR-Cas9 ».
Les CRISPR (Clustered Regularly Interspaced Short Palindromic Repeats) sont des séquences génétiques qui se répètent de loin en loin tout au long de la chaîne d'ADN.
Cas9 (CRISPR associated protein 9) est, quant à elle, une endonucléase d'ADN, guidée par ARN, qui est une enzyme spécialisée pour couper l'ADN avec deux zones de coupe actives, une pour chaque brin de la double hélice. Sa capacité à couper l'ADN au niveau de séquences spécifiques en fait donc un outil de biologie moléculaire aux vastes perspectives d'utilisation.
Comme cette CRISPR-Cas9 paraît bien obscure pour le grand public, l'expression très jolie et plus parlante de ciseaux moléculaires a été introduite. Mais que sont donc des ciseaux moléculaires ?
Une histoire qui commence au XIXe siècle
L'un des problèmes de la science actuelle est qu'elle est devenue hyperspécialisée : elle étudie « un grain de sable au milieu d'une montagne ». Or il est essentiel de connaître la montagne pour comprendre la place et le rôle du grain du sable dans cette montagne. Le grain de sable c'est la CRISPR-Cas9, la montagne c'est toute l'histoire de la génétique.
Elle commence avec le génial moine Gregor Mendel qui, au milieu du XIXe siècle, va poser les fondements de la génétique, en effectuant des croisements de petits pois dans son jardin. Il va ainsi établir, sans jamais proposer le mot « gène », les lois de l'hérédité qui ne seront plus jamais profondément contestées. Mendel mourut ignoré, en 1884, son travail ayant été publié en 1866, sous la forme d'un article de 44 pages, dans les Comptes rendus des travaux de la Société d'histoire naturelle de Brno (Tchéquie).
Ce n'est qu'en 1900 que trois botanistes, Hugo De Vries (Pays-Bas), Carl Correns (Allemagne) et Erich von Tschermak-Seysenegg (Autriche) publient, indépendamment, des résultats sur ce qui est alors appelé « la loi de dysjonction des hybrides ». La polémique issue des travaux de ces chercheurs permettra de reconnaître que leurs résultats sont identiques à ceux que Mendel avait édités 34 ans auparavant. Ils lui rendirent un hommage posthume en appelant ces lois de l'hérédité « lois de Mendel » (NDLR : deuxième loi de Mendel ou loi de dysjonction des allèles : lorsqu'on croise entre eux deux individus de générations F1, on obtient une génération F2 dans laquelle on trouve les deux versions d'un caractère dans des proportions bien définies).
En 1909, le botaniste danois Wilhelm Johannsen invente le mot « gène » pour désigner ces petits éléments qui se transmettent de génération en génération. C'est donc par les plantes et le végétal qu'est introduit cet acteur fondamental de la génétique : le gène.
Bien plus tard, c'est encore une botaniste, Barbara McClintock, qui découvrira dans le maïs les « éléments transposables » (c'est-à-dire des séquences d'ADN capables de se déplacer dans l'ADN des chromosomes), ce qui lui vaudra, en 1983, le prix Nobel de physiologie ou médecine. D'une certaine façon, on peut dire que cette botaniste américaine avait déjà découvert les premiers ciseaux génétiques.
Le développement spectaculaire de la biochimie
Parallèlement, la biochimie se développe. Celle des protéines commence avec Theodore Svedeberg, prix Nobel de Chimie en 1926, mais la découverte des acides nucléiques par le brillant scientifique suisse, Friedrich Miescher, était bien antérieure, datant de 1869. C'est ensuite la spectaculaire progression de la biochimie et la recherche du support de l'information génétique.
L'Anglais Frederich Griffith va, en 1928, démontrer pour la première fois que c'est l'ADN qui est le support de l'information génétique. Il travaillait alors sur deux souches de la bactérie Diplococcus pneumoniae. La souche S (smooth) est mortelle pour la souris, la souche R (rough) ne l'est pas. Griffith observe que la souche S, tuée par la chaleur, n'est plus létale. Il injecte alors, à la fois la souche S inactivée et la souche R vivante et constate la mort de la souris : il en déduit que la souche R a été transformée. C'est la première démonstration de la transformation bactérienne qui sera reproduite de multiples fois dans d'autres systèmes bactériens. Ces résultats suggèrent qu'il existe, dans les cellules, un « facteur transformant » libéré par la chaleur et capable de s'intégrer à d'autres bactéries. On mettra 10 ans pour révéler que ce facteur est l'ADN (Oswald Avery,1944).
Le grand Linus Pauling, prix Nobel de chimie en 1954, ayant élucidé largement la structure des protéines, confirma que l'ADN était bien le candidat le plus probable au support génétique.
Toutes les espèces vivantes parlent la même langue
Débute alors l'explosion de la génétique moléculaire avec la publication, en 1953, de la structure en double hélice de l'ADN. Cette découverte valut, en 1962, le prix Nobel de physiologie ou médecine aux jeunes et talentueux Francis Crick et James Watson.
Il faut tout de même dire qu'une actrice majeure de cette histoire fut malheureusement oubliée dans ce Nobel. C'est Rosalind Franklin qui travaillait, comme Watson et Crick, au King's College de Londres. Elle avait, de son côté, proposé des modèles pour la structure de l'ADN et avait surtout produit les remarquables clichés d'analyse par diffraction des rayons X qui furent indispensables aux lauréats pour bâtir leur modèle.
Le code génétique est par la suite décrypté, grâce aux travaux extraordinaires de plusieurs équipes et, principalement, de celle de Marshall Warren Nirenberg, biochimiste américain, colauréat du prix Nobel de physiologie ou médecine en 1968 pour avoir, le premier, déchiffré le code génétique.
On découvre alors la quasi-universalité du code, c'est-à-dire que toutes les espèces vivantes parlent la même langue, des bactéries et des virus aux organismes supérieurs, qu'ils soient animaux ou végétaux.
De François Jacob, André Lwoff et Jacques Monod à Emmanuelle Charpentier et Jennifer Douana
Était-ce la porte ouverte à la transgenèse, c'est-à-dire à la possibilité de transférer des gènes d'une espèce à l'autre ?
Il semble me souvenir que François Jacob, qui reçut en 1965 le prix Nobel de physiologie ou médecine avec ses collègues André Lwoff et Jacques Monod, pour leur découverte du « contrôle génétique des synthèses enzymatiques et virales », qui fut considérée comme l'une des contributions les plus importantes à la biologie moléculaire, avait déclaré : « Bien sûr on commence à bien comprendre tous ces mécanismes au niveau moléculaire, mais nous sommes bien loin de pouvoir les utiliser pour modifier profondément le vivant ».
L'avenir montrera qu'il se trompait. La transgenèse nous a en effet « envahis » avec une rapidité foudroyante. Mais, en réalité, elle existait déjà naturellement sans que nous nous en doutions. Depuis toujours, les bactéries et encore bien plus les virus, transfèrent des gènes d'une espèce à l'autre. Parallèlement à la transmission verticale des caractères génétiques (d'une génération à l'autre), par le biais de la multiplication cellulaire ou par la reproduction sexuée, un transfert horizontal des gènes existe aussi dans le monde vivant.
L'homme va d'ailleurs rapidement utiliser ces mécanismes naturels pour fabriquer, par exemple, des plantes transgéniques. Les premières à être commercialisées seront du soja et des cotons, modifiés par insertion de gènes, soit pour résister aux herbicides, soit pour produire des protéines insecticides.
Comment ont été introduits ces gènes ? Grâce à une bactérie, Agrobacterium tumaciens, qui pénètre naturellement dans les plantes, et est capable d'injecter un ADN dans une cellule végétale qui s'insère alors dans le génome chromosomique. Est ainsi réalisée, naturellement, une transgenèse d'une partie de ses gènes.
Le virus, remarquable transformateur
Ainsi, l'homme est maintenant capable d'intégrer un gène dans une bactérie et de l'utiliser ensuite pour transformer une plante.
Et les agents de transformation les plus efficaces sont les virus. Rappelons-nous leur statut très particulier puisqu'ils sont peut-être à l'origine de la vie sur terre.
Un virus c'est comme « un vaisseau portant un message génétique ». Tant que le vaisseau est à l'extérieur d'une cellule vivante, il est inerte, contenant un livre qu'il ne peut pas lire, un message qu'il ne peut pas utiliser. Pour agir, il lui faut envahir mécaniquement une cellule. Il intègre alors son ADN (ou son ARN, comme dans le cas du SARS-CoV-2 à l'origine de la pandémie actuelle). Il peut alors, soit demeurer passif dans l'ADN de son hôte (c'est le cas des porteurs non malades), soit se réveiller et utiliser notre machinerie cellulaire pour se reproduire, en détruisant nos cellules.
Le virus est donc un remarquable transformateur dont l'homme souhaite se servir pour tenter de modifier son propre génome et, à terme, de pouvoir guérir définitivement des maladies génétiques en injectant des gènes réparateurs.
Mais le problème principal est de cibler ces gènes avec précision en des points précis du génome. Il faut donc trouver des ciseaux moléculaires capables de reconnaître l'endroit à couper. C'est à ce problème que se sont intéressées Emmanuelle Charpentier et Jennifer Doudna.
La transgenèse, un domaine qui concerne toute la biologie
Ces travaux s'inscrivent dans le domaine de la transgenèse, un champ de recherche immense, ouvert il y a un demi-siècle et qui concerne aujourd'hui toute la biologie microbienne, animale et végétale. Le but est simple : modifier la composition protéique ou enzymatique en modifiant le génome, c'est-à-dire la structure nucléotidique de l'ADN, et donc cette double hélice portant, via le code génétique, l'alphabet universel du vivant.
De ce fait, nous vivons actuellement dans un monde biologique peuplé d'organismes transgéniques, c'est-à-dire modifiés par l'homme.
Mais toutes ces transgenèses se sont implantées dans le désordre par de multiples techniques, en modifiant, un peu au hasard, le codage par l'ADN.
L'objectif est maintenant de découper l'ADN de façon parfaitement contrôlée. Autrement dit d'intervenir sur des sites de la séquence ADN, en supprimant ou en introduisant un gène à un endroit précis de la double hélice. Les ciseaux moléculaires sont justement des protéines qui coupent l'ADN, permettant d'exciser ou d'insérer un gène en un site précis de l'ADN. Un exemple d'application serait, en cas de maladie génétique, le remplacement d'un gène déficient, par un gène sain.
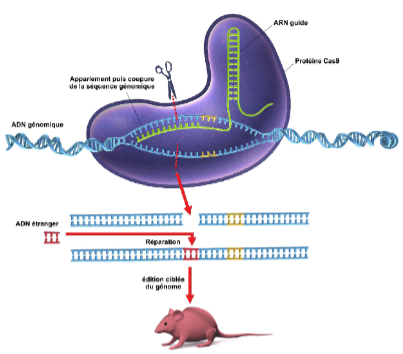
CRISPR-Cas9, un outil génétique de modification ciblée du génome
Emmanuelle Charpentier et Jennifer A. Douana se sont servies d'un système immunitaire naturel utilisé par les bactéries pour se protéger contre les infections virales. Quand une bactérie détecte une infection virale, elle produit un ARN qui correspond à celui du virus envahisseur. Cet ARN confère une résistance aux éléments génétiques étrangers provenant de plasmides (morceaux d'ADN qui peuvent se transmettre par transfert, de cellule en cellule) et de bactériophages (virus n'infectant que des bactéries), et fournit une forme d'immunité acquise. Ces chercheuses ont également montré que cette structure pouvait être conçue comme un guide « ARN » unique, et qu'en manipulant la séquence de cet ARN-guide, le système Cas9 artificiel pouvait être programmé pour cibler n'importe quelle séquence d'ADN in vitro.
Elles ont étudié la modulation de la virulence d'une bactérie par le complexe CRISPR-Cas9. Ce dernier peut être introduit et utilisé dans le noyau des cellules eucaryotes, permettant de réaliser des mutations et d'autres manipulations dans le génome des mammifères et des plantes.
En peu d'années, les systèmes fondés sur CRISPR ont profondément modifié notre savoir-faire, car ils permettent de modifier les génomes in vivo avec une précision extrêmement élevée, à moindre coût et avec facilité (voir Figure 1).
Figure 1 : les différentes étapes du processus d'édition génomique à l'aide du complexe CRISPR-Cas9 (CNRS-Le journal. Gunilla Elam / Science Photo Library / Cosmos).
Des essais cliniques sont en cours concernant l'utilisation de CRISPR dans des hémoglobinopathies telles que la drépanocytose ou la bêta-thalassémie, ainsi que pour l'immunothérapie anticancéreuse. Dans chaque cas, des cellules sont prélevées sur les patients, modifiées et réintroduites.
L'édition génomique a aussi un fort potentiel en biologie végétale et animale. Elle peut être employée pour l'amélioration des cultures (rendement, qualité, résistance aux maladies, résistance aux herbicides), et pour le bétail, où elle peut améliorer les caractéristiques de production.
Des risques à prendre en compte
Cependant d'autres défis subsistent et des risques existent.
Certains sont d'ordre technique, comme le risque de modifications hors cible. D'autres sont sociétaux. CRISPR a été notamment utilisé dans l'une des expériences les plus controversées de ces dernières années : celle du chercheur chinois He Jiankui qui a employé cette technologie pour modifier des embryons humains et les rendre résistants au VIH, ce qui a conduit à la naissance des jumelles Lulu et Nana. Il y a là des questions d'éthique, et probablement de réglementation.
Quoi qu'il en soit, depuis 2012, ces outils se répandent et le CRISPR-Cas9 est loin d'avoir dévoilé toute l'étendue de ses applications. Mais le prix Nobel, qui récompense ces travaux essentiels, est amplement justifié.
©Vidal.fr
Pour en savoir plus
- Dimitri Perrin. CRISPR : un prix Nobel pour une révolution en biologie. The Conversation. 12 octobre 2020 ; https://theconversation.com/crispr-un-prix-nobel-pour-une-revolution-en-biologie-147715
- Léa Galanopoulo CRISPR-Cas9 : des ciseaux génétiques pour le cerveau. CNRS-Le journal. mise à jour le 7 octobre 2020. https://lejournal.cnrs.fr/articles/crispr-cas9-des-ciseaux-genetiques-pour-le-cerveau
Sources
Pour recevoir gratuitement toute l’actualité par mail Je m'abonne !

 10 minutes
10 minutes 4 commentaires
4 commentaires 




Commentaires
Cliquez ici pour revenir à l'accueil.