Représentation en 3D de rétrovirus (illustration).
La doravirine est un nouvel antiviral anti-VIH-1 (Cf. VIDAL Reco "Infection par le VIH") de la classe des inhibiteurs non nucléosidiques de la transcriptase inverse (INNTI), disposant d'une autorisation de mise sur le marché (AMM) dans le traitement de l'infection par le VIH-1, en association à d'autres antirétroviraux.
Ce principe actif entre dans la composition de 2 nouveaux médicaments (Cf. Tableau I) :
- l'un sous forme libre : PIFELTRO 100 mg comprimé pelliculé,
- l'autre en association fixe avec le ténofovir disoproxil fumarate et la lamivudine : DELSTRIGO 100 mg/300 mg/245 mg comprimé pelliculé.
Tableau I - Compositions et indications thérapeutiques de DELSTRIGO et PIFELTRO
| PIFELTRO | DELTRIGO | |
| Composition en principe actif |
|
|
| Indication thérapeutique | En association avec d'autres médicaments antirétroviraux, pour le traitement des adultes infectés par le VIH-1 sans preuve antérieure ou actuelle de résistance à la classe des INNTI | Traitement des adultes infectés par le VIH-1 sans preuve antérieure ou actuelle de résistance à la classe des INNTI, à la lamivudine ou au ténofovir |
La doravirine s'inscrit dans le cadre de la stratégie thérapeutique actuelle où sont recommandées en 1re intention les combinaisons thérapeutiques associant au moins 3 agents hautement actifs, comprenant 2 INTI associés à un 3e agent : inhibiteur de protéase (IP), INNTI ou inhibiteur de l'intégrase (INI).
 PIFELTRO et DELSTRIGO font l'objet d'une surveillance supplémentaire qui permettra l'identification rapide de nouvelles informations relatives à la sécurité. Les professionnels de santé déclarent tout effet indésirable suspecté.
PIFELTRO et DELSTRIGO font l'objet d'une surveillance supplémentaire qui permettra l'identification rapide de nouvelles informations relatives à la sécurité. Les professionnels de santé déclarent tout effet indésirable suspecté.Efficacité de PIFELTRO et DELSTRIGO : évaluation de la doravirine
Dans ses avis du 3 avril 2019 (avis sur PIFELTRO, avis sur DELSTRIGO), la Commission de la Transparence a évalué l'efficacité et la tolérance de la doravirine sur la base principalement des études DRIVE-FORWARD, DRIVE-AHEAD et DRIVESHIFT (Cf. Tableau II).
Tableau II - Synthèse des études DRIVE-FORWARD, DRIVE-AHEAD et DRIVESHIFT
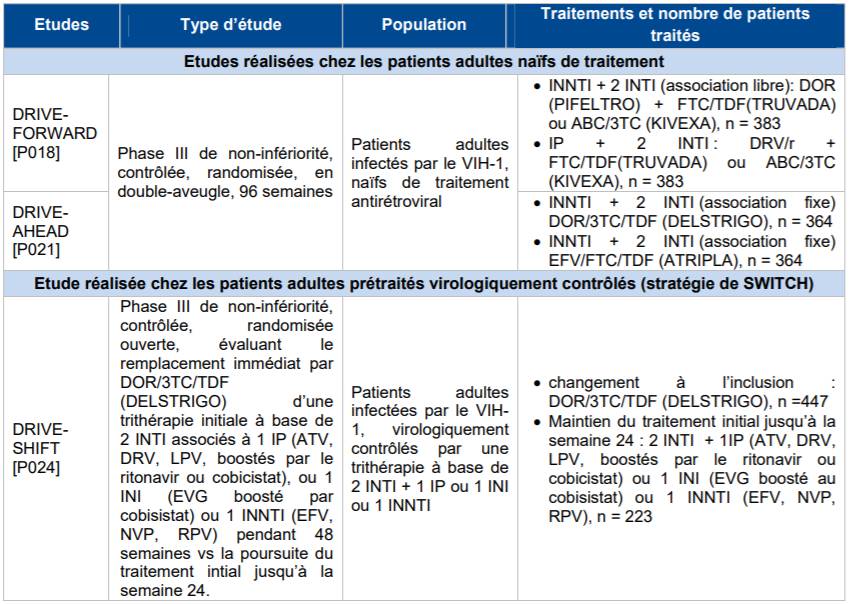
VIH-1 : Virus de l'Immunodéficience Humaine de type 1 ; DOR : Doravirine, TDF : Ténofovir disoproxil fumarate, 3TC : Lamivudine, EFV : Efavirenz, FTC : Emtricitabine, ABC : Abacavir, DRV/r : Darunavir boosté au ritonavir, ATV : Atazanavir, LPV : Lopinavir, EVG : Elvitegravir, NVP : Nevirapine, RPV : Rilpivirine.
Selon les résultats des études DRIVE-FORWARD et DRIVE-AHEAD la non-infériorité de la doravirine, sous forme libre (PIFELTRO) ou en association fixe (DELSTRIGO) a été montrée versus darunavir/ritonavir (IP) ou éfavirenz (ATRIPLA), en termes d'efficacité immuno-virologique après 96 semaines de traitement, chez des adultes naïfs de traitement antirétroviral sans antécédent de mutation de résistance à la doravirine et aux médicaments associés.
La Commission de la Transparence précise qu'il existe "des incertitudes sur l'efficacité de la doravirine chez les patients ayant une charge virale élevée (> 100 000 copies/mL), population dans laquelle il a été observé un faible niveau de succès virologique (environ 70 % à 96 semaines)".
L'étude DRIVESHIFT a par ailleurs montré l'efficacité de l'association doravirine/lamivudine/ténofovir disoproxil (DELSTRIGO) chez les patients prétraités virologiquement contrôlés depuis au moins 6 mois, sans antécédent d'échec virologique et de résistance à la classe des INNTI, à l'emtricitabine, au ténofovir, à la lamivudine.
La Commission de la Transparence indique que "l'absence d'analyse en population per protocole ne permet pas de conclure sur sa non-infériorité versus le maintien du traitement initial (IP/ritonavir ou elvitégravir/cobicistat essentiellement)".
En termes de tolérance, le profil de la doravirine a été comparable à celui du darunavir/ritonavir, et plus favorable que celui de l'éfavirenz (ATRIPLA), en particulier sur le plan neurologique (vertiges et maux de têtes), mais sans différence significative pour les effets indésirables neuropsychiatrique les plus sévères (dépression, suicides et troubles bipolaires).
En termes de résistance, les données disponibles suggèrent une barrière génétique de résistance à la doravirine relativement faible, en raison de la fréquence élevée de résistance à la doravirine et aux INTI associées en cas d'échec virologique, en particulier dans le cadre de son utilisation en association au ténofovir disoproxil fumarate/lamivudine (DELSTRIGO).
En conclusion de ses avis, la Commission de la Transparence considère que le service médical rendu (SMR) par PIFELTRO et DELSTRIGO est important chez les patients atteints du VIH-1 ayant une charge virale faible <= 100 000 copies/mL, lorsqu'un INNTI est indiqué et que l'utilisation de la rilpivirine n'est pas appropriée, sans amélioration du SMR dans la prise en charge des patients infectés par le VIH-1 (ASMR V).
PIFELTRO et DELSTRIGO en pratique
La posologie de PIFELTRO 100 mg comprimé pelliculé et de DELSTRIGO 100 mg/300 mg/245 mg comprimé pelliculé est de 1 comprimé 1 fois par jour par voie orale.
Dans les 2 cas, l'administration peut être faite avec ou sans nourriture.
- Co-administration avec la rifabutine : augmenter la dose de doravirine
Dans le cas de la coadministration de doravirine et de rifabutine, la dose quotidienne de doravirine doit être doublée :
- pour PIFELTRO 100 mg : la posologie passe à 1 comprimé 2 fois par jour (à environ 12 heures d'intervalle) ;
- pour DELSTRIGO : pour doubler uniquement la dose de doravirine, un comprimé de PIFELTRO est ajouté une fois par jour, en respectant 12 heures de délai environ entre l'administration de ce comprimé et celui de DELSTRIGO.
La dose de doravirine doit également être doublée en cas de co-administration de doravirine avec d'autres inducteurs modérés du CYP3A (par exemple, dabrafénib, lésinurad, bosentan, thioridazine, nafcilline, modafinil, éthyle de télotristat) ; dans ces situations, une diminution des concentrations de doravirine est attendue.
Si la co-administration avec d'autres inducteurs modérés du CYP3A ne peut pas être évitée, les schémas posologiques suivants doivent être appliqués :
- traitement par PIFELTRO : 1 comprimé de PIFELTRO 2 fois par jour (à environ 12 heures d'intervalle) ;
- traitement par DELSTRIGO : 1 comprimé de DELSTRIGO 1 fois par jour, plus 1 comprimé de PIFELTRO 100 mg 1 fois par jour, avec une délai d'environ 12 heures entre les prises.
Surveiller la fonction rénale des patients sous DELSTRIGO
Les patients sous DELSTRIGO doivent bénéficier d'une surveillance rénale, en raison de la formulation en ténofovir disproxil.
Avant d'instaurer le traitement par DELSTRIGO, il est recommandé d'évaluer la ClCr (clairance de la créatinine) estimée chez tous les patients.
Cette surveillance doit être maintenue pendant le traitement si la situation clinique le justifie.
En raison d'une éventuelle toxicité rénale, le traitement par DELSTRIGO doit être évité en cas d'utilisation concomitante ou récente de médicaments néphrotoxiques, par exemple des médicaments anti-inflammatoires non stéroïdiens (AINS) à doses fortes ou multiples.
Identité administrative
- Liste I
- Prescription initiale hospitalière annuelle
- Renouvellement non restreint
- Pour PIFELTRO : Flacon de 30, CIP 3400930161340, Prix public TTC = 281,14 euros
- Pour DELSTRIGO : Flacon de 30, CIP 3400930161357, Prix public TTC = 470,97 euros
- Remboursable à 100 % (Journal officiel du 20 août 2019 - texte 4)
- Agrément aux collectivités (Journal officiel du 20 août 2019 - texte 5)
- Laboratoire MSD France
Encadré - Périmètre de prise en charge de DELSTRIGO et PIFELTRO
| Patients ayant une charge virale faible < ou = à 100 000 copies/mL, lorsqu'un INNTI (inhibiteurs non nucléosidiques de la transcriptase inverse) est indiqué et que l'utilisation de la rilpivirine n'est pas appropriée. |
Pour aller plus loin
Avis de la Commission de la Transparence - PIFELTRO (HAS, 3 avril 2019)
Avis de la Commission de la Transparence - DELSTRIGO (HAS, 3 avril 2019)
Etudes pivots :
- Molina JM, Squires K, Sax PE, Cahn P, Lombaard J, DeJesus E et al. Doravirine versus ritonavir-boosted darunavir in antiretroviral-naive adults with HIV-1 (DRIVE-FORWARD): 48-week results of a randomised, double-blind, phase 3, noninferiority trial. Lancet HIV. 2018 May ; 5(5) : e211-e220 (abstract)
- Orkin C, Squires K.E, Molina JM, Sax PE, Wong WW, Sussmann O. Doravirine/Lamivudine/Tenofovir Disoproxil Fumarate is Non-inferior to Efavirenz/Emtricitabine/Tenofovir Disoproxil Fumarate in Treatment-naive Adults With Human Immunodeficiency Virus–1 Infection: Week 48 Results of the DRIVE-AHEAD Trial. Clin Infect Dis. 2018 Aug 31
- Switching to Doravirine/Lamivudine/Tenofovir Disoproxil Fumarate (DOR/3TC/TDF) Maintains HIV-1 Virologic Suppression Through 48 Weeks: Results of the DRIVE-SHIFT Trial. J Acquir Immune Defic Syndr. 2019 Aug 1;81(4):463-472
Pour aller plus loin
Consultez les monographies VIDAL
Consultez les VIDAL Recos
Sources
Pour recevoir gratuitement toute l’actualité par mail Je m'abonne !

 6 minutes
6 minutes Ajouter un commentaire
Ajouter un commentaire.jpg)
.jpg)




Commentaires
Cliquez ici pour revenir à l'accueil.